A medida que surgen los componentes multisistémicos de COVID-19, se pueden trazar etiologías paralelas entre la infección por SARS-CoV-2 y las lesiones por radiación.
Si bien algunas personas infectadas con SARS-CoV-2 se presentan asintomáticas,
otras presentan síntomas leves que pueden incluir fiebre, tos, escalofríos y síntomas inusuales como pérdida del gusto y el olfato y enrojecimiento de las extremidades (p. de daño de microvasos).
Otros alarman a los proveedores de atención médica con la
aparición extrema y rápida de indicadores de mortalidad de alto riesgo que incluyen el síndrome de dificultad respiratoria aguda (SDRA), hipercoagulación multiorgánica, hipoxia y daño cardiovascular.
Los investigadores están reorientando rápidamente su ciencia para abordar este enigmático virus que parece revelarse de nuevas formas sin discriminación. A medida que los investigadores comienzan a identificar marcadores tempranos de enfermedad, la identificación de hilos comunes con otras patologías puede proporcionar algunas pistas.
Curiosamente,
años de investigación en el campo de la biología de la radiación documentan la naturaleza multiorgánica compleja de otro estado de enfermedad que se produce después de la exposición a altas dosis de radiación: el síndrome de radiación aguda (ARS).
La inflamación es un actor común clave en COVID-19 y ARS, y provoca el daño multisistémico que altera drásticamente la homeostasis biológica. Ambas condiciones inician una tormenta de citocinas, con un aumento de moléculas proinflamatorias similares y una disminución de otras moléculas antiinflamatorias.
Estos cambios se manifiestan en una variedad de formas, con un impacto de salud demostrablemente mayor en pacientes que tienen condiciones médicas subyacentes. El impacto humano potencialmente dramático del ARS ha guiado la ciencia que ha identificado muchos biomarcadores de exposición a la radiación, estableció estrategias de gestión médica para ARS y condujo al desarrollo de contramedidas médicas para su uso en caso de una emergencia de salud pública por radiación. Estos esfuerzos ahora se pueden aprovechar para ayudar a dilucidar los mecanismos de acción de las lesiones por COVID-19.
Además,
esta intersección entre COVID-19 y ARS puede apuntar a enfoques que podrían acelerar el descubrimiento de tratamientos para ambos.
INTRODUCCIÓN
El mundo se encuentra actualmente en las garras de una pandemia global. Hasta el 10 de septiembre de 2020, se han notificado en todo el mundo más de 50 millones de casos de COVID-19, la enfermedad causada por el síndrome respiratorio agudo severo coronavirus 2 (SARS-CoV-2). A la vanguardia de las actividades de investigación dirigidas a combatir el COVID-19 se encuentra el Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID) dentro de los Institutos Nacionales de Salud (NIH) de EE. UU. En abril de 2020, el NIAID publicó el Plan estratégico del NIAID para la investigación de COVID-19 2describiendo los esfuerzos del NIAID para comprender mejor el SARS-CoV-2 y acelerar el desarrollo de herramientas biomédicas seguras. El plan es un documento bien definido que se centra en cuatro prioridades de investigación: mejorar el conocimiento fundamental de SARS-CoV-2 y COVID-19; apoyar el desarrollo de diagnósticos y ensayos; caracterizar y probar terapias; y desarrollar vacunas seguras y eficaces contra el SARS-CoV-2. En el documento se describe un plan de investigación detallado para cada área prioritaria.
La novedad de la nueva enfermedad por coronavirus de 2019 (COVID-19) se destaca por el hecho de que no existen terapias aprobadas o autorizadas por la FDA específicas para los coronavirus. La ruta tradicional de desarrollo de fármacos para terapias (y herramientas de diagnóstico) puede ser un proceso de años con hitos que requieren grandes recursos para alcanzar. Sin embargo, la urgencia de la pandemia de COVID-19 enfatiza la necesidad de un rápido desarrollo y prueba de candidatos terapéuticos y de diagnóstico prometedores. Se están explorando enfoques para acelerar el proceso de desarrollo en otras áreas de la ciencia donde se pueden investigar tendencias superpuestas. Las terapias desarrolladas para otras indicaciones clínicas podrían potencialmente reutilizarse para tratar COVID-19; algunas de esas posibilidades se discuten en esta revisión. Igualmente,
Las características patológicas y la forma de progresión de otras indicaciones similares a COVID-19 podrían dilucidar cómo mitigar y tratar esta enfermedad de manera efectiva.
En esta revisión,
describimos los paralelismos observados entre COVID-19 y los efectos biológicos de la lesión por radiación que incluyen componentes inmediatos y a largo plazo: el síndrome de radiación aguda (ARS) y los efectos retardados de la exposición a la radiación aguda (DEARE).
El Programa de Contramedidas Nucleares y de Radiación (RNCP) dentro del NIAID es uno de esos programas en los que el trabajo científico es relevante para la respuesta al COVID-19. El RNCP se inició en 2004, con la misión de apoyar la investigación para desarrollar contramedidas médicas para diagnosticar (biodosimetría) y tratar las lesiones por radiación que conducen a ARS y DEARE a raíz de una emergencia de salud pública por radiación.
Las marcadas similitudes entre COVID-19 y las lesiones por radiación descritas en esta revisión tienen un fundamento importante: la respuesta inflamatoria.
Varios productos actualmente en desarrollo dentro del RNCP para tratar la exposición a la radiación operan al atacar la inflamación que puede provocar daño tisular. De hecho,
los enfoques desarrollados para tratar la fibrosis pulmonar y el daño vascular inducidos por la radiación merecen ser investigados y se analizan aquí en el contexto de la COVID-19.
OBJETIVOS
- Aquí destacamos algunos de los sistemas y áreas inmunológicas afectadas tanto por covid-19 como por la exposición aguda a la radiación, aunque a diferentes niveles.
- En ambos casos, el resultado es un insulto sistémico que puede causar daño a muchas partes del cuerpo, incluyendo el sistema vascular, pulmón, corazón, riñones, hígado, intestino, ojos y cerebro. Independientemente del órgano objetivo, la hiperactivación de las vías inmunogénicas está en el corazón de la respuesta del cuerpo para superar el SARS-CoV-2 y la exposición aguda a la radiación (1).
- Las citoquinas son producidas por una variedad de células inmunes (es decir, macrófagos, linfocitos B, linfocitos T y mástil) y células no inmunes (es decir, endoteliales, fibroblastos y estromales). En circunstancias normales, las citoquinas tienen una vida media corta y actúan como mediadores locales dentro de un microambiente; por lo tanto, las citoquinas circulantes en la sangre están por debajo del límite de detección de la mayoría de los kits de ensayo disponibles comercialmente (2).
- Esta compleja red de comunicación proporciona a un sistema inmunológico saludable las señales adecuadas para montar una respuesta proporcionada contra un agente infeccioso o estímulos inflamatorios. En otros casos, la reacción es tan fuerte que los niveles circulantes de citoquinas aumentan, lo que resulta en una «tormenta de citoquinas» (también llamada hipercitoquinemia).3) o una sobreacción del sistema inmunitario que crea una respuesta inflamatoria generalizada que puede provocar daño tisular sistémico.
- La tormenta de citoquinas es el nexo entre la infección por SARS-CoV-2 y la exposición a la radiación; ambos resultan en inflamación sistémica que devasta el cuerpo (1, 3).
- Una gran cantidad de literatura temprana ha descrito el síndrome de tormenta de citoquinas (CSS) en pacientes con COVID-19 (4-15). Por ejemplo, en un estudio de 50 pacientes, los niveles de expresión de 14 de las 48 citoquinas estudiadas se asociaron con la gravedad y progresión de la enfermedad, con la proteína 10 inducida por interferón (IFN) inducida por γ y la proteína quimiotáctica de monocitos-3 observada como excelentes predictores de la progresión de la enfermedad (16).
- También se observaron aumentos en el factor estimulante de colonias de granulocitos-macrófagos (GM-CSF) y la interleucina-6 (IL-6) debido a la sobreactivación de las células T (17). Otro estudio retrospectivo con 3.939 pacientes muestra formas leves y graves de la enfermedad COVID-19 que resultan en cambios en los subconjuntos de leucocitos circulantes y la secreción de citoquinas (8). En particular, Vaninov et al. observó que los altos niveles persistentes de tres citoquinas (CXCL10, CCL7 y antagonista de los receptores il-1) se asociaron con un aumento de la carga viral, pérdida de la función pulmonar, lesión pulmonar y un desenlace fatal (12). Sobre la base de este tipo de hallazgos de niveles elevados de citoquinas específicas, en junio de 2020 la FDA emitió una Autorización de Uso de Emergencia (EUA) para una prueba de diagnóstico in vitro basada en la medición de los niveles circulantes de IL-6 en suero o plasma para el manejo de pacientes con COVID-194 (discutido con más detalle a continuación). Sin embargo, las tecnologías emergentes que miden las «firmas de citoquinas» demuestran la variabilidad entre los sujetos y destacan la necesidad del desarrollo de tratamientos personalizados basados en estos datos.
Como se observa con COVID-19, las citoquinas también son liberadas por muchas células después de la exposición a la radiación, incluidas las células endoteliales, los fibroblastos, las células inmunes y las células parenquimatosas. Se cree que la interacción y la activación temprana de reacciones inflamatorias que involucran proteínas en cascada de citoquinas, como el factor de crecimiento de fibroblastos (FGF), el factor de crecimiento transformador (TGF), el factor de necrosis tumoral (TNF-α) y las interleucinas (IL) son responsables de DEARE. Las citoquinas y quimiocinas que atraen a las células inmunes y conducen a la inflamación incluyen IL-1α e IL-6. Las células inflamatorias causan muchos otros cambios, como la muerte celular, la promoción de la fibrosis y la hinchazón del tejido. Estas citoquinas están involucradas en reacciones tempranas y tardías, como las citoquinas principales en la respuesta de las células de la piel a la radiación ionizante, e incluyen IL-1, IL-6, factor de necrosis tumoral (TNF)-α, factor de crecimiento transformador (TGF)-β, que puede ser pro o antiinflamatorio dependiendo del tejido y el contexto de liberación, y las quimiocinas IL-8 y eotaxina (18 ). Las citoquinas se pueden agrupar ampliamente como citoquinas proinflamatorias como TNF-α, IL-1α y β, IL-17; factor de crecimiento endotelial angiogénico/vascular (VEGF), TNF-α y FGF; IL-4, IL-10 y TGF-β antiinflamatorios; IL-6 profibrótica y TGF-β; IL-2, IL-4 e IL-7 inmunes; y CSF1 hematopoyético, GM-CSF, IL-3 y EPO (19). Curiosamente, la persistencia de citoquinas inflamatorias, quimiocinas y factores de crecimiento, como TGF-β, IFN-γ, ET-1, IL-4, IL-13, conducen a fibrosis pulmonar (20). En particular, la IL-6, que parece ser un actor clave en la respuesta al SARS-CoV-2, también se altera después de la irradiación; sin embargo, su papel en la lesión pulmonar inducida por radiación aún no está claro (21).
Además de la tormenta de citoquinas, la desregulación del sistema renina-angiotensina (RAS) juega un papel crítico en la patogénesis de COVID-19 (22) y la exposición a la radiación. La vía RAS, que regula el sistema de regulación de líquidos del cuerpo, depende de la enzima convertidora de angiotensina (ACE) y ACE2. La ECA regula la presión arterial, el agua y los niveles de sodio, así como la inflamación, la proliferación y la vasoconstricción. ACE2, el receptor objetivo del SARS-CoV-2, está involucrado en la degradación de AngII para producir Ang 1-7 y luego a la angiotensina 1-5, que es el péptido efector (23). ACE2 se puede encontrar en una variedad de órganos (por ejemplo, corazón, riñón, tejido adiposo, células del músculo liso vascular, tejido cerebral, testículos, tracto gastrointestinal (GI), etc.). Juntos ACE/ACE2 promueven la vasodilatación para reducir la presión arterial y mantener la homeostasis del RAS. ACE2 se expresa en todo el cuerpo, por lo que no es de extrañar que desempeñe muchas funciones fisiológicas, que se extienden más allá de su capacidad para reducir la presión arterial. Estos incluyen protección cardíaca y pulmonar por ACE2. Un estudio con ratones realizado por Imai et al. muestra que AngII, regulado al alza por ACE, impulsa la insuficiencia pulmonar grave a través del receptor AT1a, mientras que ACE2 y los receptores AT2 protegen contra la lesión pulmonar. El grupo mostró que la ACE2 humana recombinante exógena reduce la insuficiencia pulmonar aguda en ratones ACE2 knockout y de tipo salvaje (24, 25), e impacta la desregulación gastrointestinal y las complicaciones diabéticas (26). Como el SARS-CoV-2 (27) se une a ACE2, es posible que los receptores ACE2 estén regulados a la baja, causando un desequilibrio en el RAS (28).
Tanto los desequilibrios de citoquinas como de RAS pueden tener implicaciones en el desarrollo de lesiones pulmonares y de otros órganos tanto para COVID-19 (3, 22, 27) como para la exposición a la radiación ionizante (29, 30), aunque la interacción es compleja y no se entiende completamente. En general, la infección por SARS-CoV-2 (31) y la exposición a la radiación ionizante (31) desencadenan citoquinas proinflamatorias (por ejemplo, IFN-α, IFN-γ, IL-1β, IL-6, IL-12, IL-18, IL-33, TNF-α, TGF-β, etc.). En el caso de la COVID-19, el pulmón es la diana inicial más prevalente y, en algunos casos, la lesión progresa de neumonitis (32, 33) al síndrome de dificultad respiratoria aguda (SDRA). Esta mayor respuesta inflamatoria crónica crea un ambiente profibrótico que produce fibrosis a largo plazo seguida de disfunción orgánica. Del mismo modo, la exposición a la radiación también puede provocar fibrosis pulmonar (34-36), así como lesiones en otros órganos (37-39).
La vasculatura también es atacada por el SARS-CoV-2, como lo demuestra la prevalencia de eventos trombóticos sistémicos (40), endoteliitis (inflamación endotelial) (41) y «dedos de los pies COVID» (que sugieren disfunción de los microvasos en las extremidades) (42, 43). Se ha demostrado que el virus infecta directamente las células endoteliales (41), y su desregulación posterior probablemente explica las muchas coagulopatías vasculares y trombosis que se han observado en pacientes con COVID-19. Recientemente, Zamboni (44) describió covid-19 como una enfermedad vascular, con la célula endotelial emergiendo como un potente objetivo para el SARS-CoV-2, mientras que el endotelio se llama «el eje» de la patogénesis de COVID-19, orquestando la tormenta de citoquinas y el daño a múltiples órganos (45). En casos graves, esta disfunción ha dado lugar a accidentes cerebrovasculares (46) y otra afectación cardiovascular (47). Del mismo modo, la exposición aguda a la radiación conduce a una lesión vascular (48) a través de la apoptosis y la senescencia de las células endoteliales, así como a través de un aumento de las moléculas de adhesión celular (49) y la desregulación de la homeostasis de la coagulación (50).
Otro objetivo común del SARS-CoV-2 y la exposición aguda a la radiación es la vía de piroptosis o muerte celular programada dependiente de la caspasa-1 de las células eucariotas. La piroptosis es un mecanismo por el cual el sistema inmune innato del cuerpo elimina los patógenos y promueve una respuesta inmune adaptativa. La caspasa-1 inicia la inflamación que resulta en la formación de poros de membrana plasmática en células infectadas por patógenos, permitiendo que entre agua, causando hinchazón y lisis osmótica. Además, la caspasa-1 promueve la escisión del ADN cromosómico y la condensación nuclear. La caspasa-1 es activada por receptores tipo Toll (TLR) y receptores similares a NOD (NLR) presentes en las células inmunes, como los macrófagos o las células epiteliales, que detectan señales de peligro extracelulares e intracelulares producidas por patógenos o lesiones tisulares. Esta red de comunicación celular da como resultado una cascada inflamatoria iniciada por NF-κB, vías dependientes de la proteína quinasa activada por mitógenos (MAPK) y del factor regulador del interferón (IRF), activando ifn-α/β, TNF-α/β, IL-12, IL-6, IL-8 y pro-IL-1β. La vía de la piroptosis también está implicada en la muerte de las células inmunes (por ejemplo, en el bazo) después de la exposición aguda a la radiación (51, 52). Además, la vía de señalización NF-κB/TNF-α también se activa en respuesta a la radiación ionizante, lo que resulta en una cascada de citoquinas similar. De hecho, un estudio publicado recientemente mostró que la piroptosis puede desempeñar un papel en la inflamación pulmonar y la fibrosis inducidas por la radiación (53).
BIOMARCADORES
Biomarcadores en fisiopatología de COVID-19 y lesiones por radiación
Existe una notable similitud en el patrón de respuesta de los biomarcadores a la infección por SARS-CoV-2 y la exposición a la radiación.
Se observan cambios significativos en los biomarcadores hematológicos, químicos, inflamatorios e inmunes en COVID-19 y en pacientes irradiados.
Aunque el insulto (infección o exposición aguda a la radiación) es muy diferente,
las patologías resultantes convergen a la disfunción multiorgánica (MOD), lo que resulta en insuficiencia multiorgánica (MOF) y mortalidad.
Los biomarcadores únicos para cada insulto, como la disfunción del olfato para COVID-19, o los enfoques citogenéticos, genómicos o metabolómicos para la biodosimetría de radiación no se discuten aquí.
Hematología
El enfoque clásico de la hematología se ha convertido en una herramienta valiosa para predecir los resultados, así como para estratificar y manejar a los pacientes con COVID-19 (54-59). Por ejemplo, un análisis retrospectivo comparó los recuentos de hemocitos (neutrófilos, linfocitos y plaquetas; o «puntuación de PNL») y encontró una fuerte correlación entre la puntuación de PNL y la progresión de la enfermedad COVID-19, mientras que otro estudio publicado observó una disminución de linfocitos asociada con la gravedad de COVID-19 (60, 61). Además, Chen et al. realizó un estudio retrospectivo en 548 pacientes y observó que los recuentos de linfocitos, subconjuntos de células T, eosinófilos y plaquetas disminuyeron notablemente, especialmente en pacientes graves / críticos y fatales. El aumento del recuento de neutrófilos y la relación neutrófilos-linfocitos fueron predominantes en casos graves/críticos o no supervivientes (61). A partir de estudios separados, se observó que un aumento en la proporción de neutrófilos a linfocitos (NLR) es una señal de alerta temprana para COVID-19 grave (59, 62, 63). Estos datos están respaldados además por los hallazgos de un estudio publicado de 75 pacientes de Suzhuo, China, con infección confirmada por COVID-19; Los índices hematológicos anormales comunes de COVID-19 al ingreso incluyeron hiperfibrinogenemia, linfopenia, elevación del dímero D y leucopenia, que fueron significativamente diferentes entre los grupos de COVID-19 leve/moderado y grave. Además, el cambio dinámico del nivel de NLR y Dímero D puede distinguir los casos graves de COVID-19 de los leves/moderados (64).
Los datos hematológicos podrían refinarse aún más para interrogar a una población de una sola célula (como linfocitos o plaquetas) que produjo una correlación significativa con la progresión y la gravedad de COVID-19. Un metanálisis de 3.099 pacientes de 24 estudios diferentes mostró que los pacientes a los que no les fue bien tenían recuentos bajos de linfocitos (diferencia de medias de – 361,06/μl) en comparación con los pacientes que tuvieron buenos resultados (65). Otros investigadores también han informado de la linfopenia como un biomarcador clave en pacientes con COVID-19 (66-68); Terpos et al. (68) se refirió a la linfopenia como «un hallazgo cardinal de laboratorio, con potencial pronóstico», instando a la necesidad de una evaluación longitudinal de los parámetros para seguir la dinámica de la progresión de la enfermedad. La trombocitopenia también se observa comúnmente entre los pacientes hospitalizados con COVID-19 y un recuento bajo de plaquetas se asocia con una mayor mortalidad (57, 69-74). Se plantea la hipótesis de que el SARS-CoV-2 infecta tanto las células de la médula ósea como las plaquetas a través del receptor CD13, induciendo la inhibición del crecimiento y la apoptosis. Esta entrada interrumpe la hematopoyesis, lo que resulta en trombocitopenia. Otra causa de trombocitopenia se atribuye a la lesión pulmonar debido a la activación, agregación y retención de plaquetas en el pulmón. La formación de trombos en el sitio de la lesión pulmonar conduce a una disminución de la producción de plaquetas y un mayor consumo (75, 76). Curiosamente, en la mayoría de los casos las disminuciones plaquetarias no alcanzaron un nivel en el que se produjera sangrado espontáneo.
Como se observa con pacientes con COVID-19, la exposición a la radiación también produce perturbaciones hematológicas profundas en humanos, así como en modelos animales irradiados, caracterizados por granulocitopenia, linfopenia y trombocitopenia (77-81).
A diferencia de COVID-19, las disminuciones significativas en los neutrófilos, además de otras citopenias, es un sello distintivo del ARS (82). La base de datos SEARCH (System for Evaluation and Archiving of Radiation accidents based on Case Histories) (82) contiene 824 casos clínicos de 81 accidentes de radiación en 19 países y permite un análisis detallado del curso temporal del ARS, con la intención de estudiar todos los aspectos médicos del ARS y derivar protocolos de tratamiento médico para víctimas de accidentes de radiación (MEdical TREatment ProtocOLs; METREPOL) (83). El síndrome hematopoyético puede caracterizarse por la cinética del recuento de granulocitos (84). El Manejo Médico de Emergencia por Radiación (REMM)5 El sitio web proporciona orientación sobre el triaje de víctimas de accidentes por radiación basado en la cinética de agotamiento de linfocitos. Se ha demostrado que la cinética del agotamiento de los linfocitos está directamente relacionada con la dosis de radiación absorbida de 0,5 a 10 Gy (85-87). Además, se ha empleado la proporción de neutrófilos a linfocitos para determinar la exposición a la dosis de radiación (88-90). Curiosamente, el agotamiento plaquetario solo no se ha utilizado para determinar la dosis de radiación, aunque la trombocitopenia se correlaciona directamente con la dosis de radiación y la utilización de plaquetas en los sitios de sangrado activo.
Biomarcadores séricos
Los pacientes con COVID-19 moderado y grave mostraron un aumento significativo en los niveles séricos de amiloide A (SSA), proteína C reactiva (PCR) que se correlacionó positivamente con la neumonía por COVID-19 (24) y los niveles de albúmina sérica (ALB) (P < 0,05) (62).
La radiación también induce aumentos en el proteoma sérico y urinario. La PCR y la amilasa sérica suelen estar elevadas después de la exposición a la radiación (91–93). En el accidente de criticidad en Tokaimura, los tres pacientes presentaron amilasa sérica elevada (94). Se informó que los niveles de PCR se correlacionaban con el resultado clínico en pacientes expuestos a radiación durante el accidente nuclear de Chernobyl (95). De un estudio publicado que identificó 260 proteínas sensibles a la radiación (96), Partridge et al. (97) redujo el panel a los niveles de IL-6, IL-1β, TNF-α y TGF-β como fuertemente correlacionados con la irradiación, y la IL-6 emergió como el mejor marcador de exposición a la COVID-19 y a la radiación aguda.
Electrólitos
Se observa desequilibrio electrolítico con reducción de potasio, calcio, cloruro y sodio en pacientes con COVID-19 (72, 76, 98). El análisis agrupado de los datos sobre electrolitos séricos confirma que la hiponatremia, la hipopotasemia y la hipocalcemia se asocian con la gravedad de la COVID-19; sin embargo, los autores advirtieron que la información adicional como las concentraciones de calcio, los niveles séricos de albúmina y el estado de líquidos de los pacientes es necesaria para una interpretación precisa de los hallazgos de laboratorio (99). Curiosamente, los autores establecen una correlación entre el desequilibrio electrolítico y la progresión de la enfermedad COVID-19 y MOF. El SARS-CoV-2 se une a su receptor huésped, ACE2, y reduce la expresión de ACE2, lo que lleva a un aumento de la angiotensina II, que puede causar un aumento de la excreción de potasio por los riñones que resulta en hipopotasemia, mientras que la angiotensina PLAS II se supone que es un mediador del SDRA y el consiguiente MOF observado en un número significativo de pacientes con COVID-19 (100). Otra causa de pérdida de electrolitos en pacientes con COVID-19 se atribuye a causas gastrointestinales como diarrea y emesis (101). Los Centros para el Control de Enfermedades (CDC) de los Estados Unidos han descrito un desequilibrio electrolítico similar, acompañado de diarrea y emesis, debido al daño y la interrupción del intestino después de la exposición a la radiación (102, 103).
Existe una notable similitud en el patrón de respuesta de los biomarcadores a la infección por SARS-CoV-2 y la exposición a la radiación. Se observan cambios significativos en los biomarcadores hematológicos, químicos, inflamatorios e inmunitarios en pacientes con COVID-19 e irradiados. Aunque el insulto (infección o exposición aguda a la radiación) es muy diferente, las patologías resultantes convergen en una disfunción multiorgánica (MOD), lo que da como resultado una falla multiorgánica (MOF) y mortalidad. Los biomarcadores únicos para cada insulto, como la disfunción del olfato para COVID-19, o los enfoques citogenéticos, genómicos o metabolómicos para la biodosimetría de radiación no se discuten aquí.
Biomarcadores inmunes
Los recuentos de linfocitos proporcionan una instantánea rápida del pronóstico de los pacientes con COVID-19. Profundizar en los subconjuntos de linfocitos proporciona una comprensión más clara del estado inmunológico del paciente, con valor diagnóstico y pronóstico (104). En un estudio de 103 pacientes, se informó una disminución significativa en las poblaciones de células T. En particular, los recuentos de células CD3, CD4, CD8 y NK disminuyeron, con la relación CD4/CD8 aumentada en pacientes con COVID-19 en comparación con los controles sanos (105). En otros estudios publicados, se observó una correlación entre la gravedad de la enfermedad y la reducción de las subunidades de células T (61, 66), así como las disminuciones en el número de células B (106).+++++
Los cambios persistentes en el sistema inmunitario después de la exposición a la radiación se manifiestan como anomalías en las poblaciones linfoides y la función (107). Los estudios de radiación han documentado cambios inmediatos en los subconjuntos de células T (108) y células B (109) relacionados con la dosis de radiación. En particular, el agotamiento de las células CD8 se ha correlacionado con la radiación absorbida a dosis bajas (110). En los sobrevivientes de la bomba atómica (bomba atómica), una disminución en las poblaciones de células T auxiliares de CD4, una función atenuada de las células T, así como un aumento en las poblaciones de células B, lo que podría impulsar la inflamación a largo plazo. También se ha informado de una reducción dependiente de la dosis de radiación en la población de células CD4 (111, 112). Si bien estas métricas no se utilizan para monitorear la progresión de la enfermedad, son indicaciones de la disfunción inmune continua observada en pacientes después de la exposición a la radiación (113).++
Disfunción vascular
El análisis histológico de COVID-19 ha demostrado que la presencia de SARS-CoV-2 dentro de las células endoteliales se asoció con grupos de células inflamatorias, lo que sugiere que la infección inicia la endoteliitis en todo el cuerpo humano, lo que lleva a una disfunción sistémica macro y microcirculatoria en los lechos vasculares (44). El VEGF-D se observó como un biomarcador procoagulante indirecto de la progresión de COVID-19 (114) y la angiopoyetina-2 (un marcador de activación endotelial), se asoció con disfunción microvascular (115). Se informó que las anomalías vasculares como el engrosamiento vascular, detectado por tomografía computarizada (TC) torácica, se asociaron significativamente con COVID-19, en comparación con la neumonía no COVID-19 (59% versus 22%, P < 0,001) (116). En última instancia, la endoteliopatía converge con las coagulopatías asociadas a COVID-19; un estudio publicado recientemente mostró una elevación significativa en los marcadores de activación de células endoteliales y plaquetas con una mortalidad fuertemente correlacionada con el antígeno del factor von Willebrand (VWF) y la trombomodulina plasmática (117).
También se ha reportado disfunción vascular resultante de la exposición a la radiación. De las 28 personas que murieron dentro de los 98 días posteriores al incidente de criticidad de Chernobyl, las muertes se atribuyeron a reacciones cutáneas, gastrointestinales y pulmonares, pero la mayoría de las muertes se caracterizaron por problemas circulatorios, con una alta incidencia de edema y hemorragias focales (118). Después del accidente de la planta nuclear de Tokaimura en Tokai, Japón, Akashi discutió el posible papel de la inflamación y la hemorragia en el MOF inducido por la radiación. En una revisión de 110 historias de casos de accidentes de radiación que abarcan desde 1945 hasta 2000, los autores analizaron MOF después de la irradiación corporal total (LCT) y declararon que «… la sintomatología de la afectación del sistema de órganos podría atribuirse no sólo a la fisiopatología de los sistemas de renovación celular que cambian rápidamente, sino, de igual o más importancia, al sistema vascular y, específicamente, a los componentes endoteliales». (119). El objetivo principal de la lesión por radiación de la vasculatura es la célula endotelial. La fase aguda del daño ocurre en cuestión de horas a semanas después de la irradiación, y se caracteriza por hinchazón endotelial, permeabilidad vascular y edema, adhesión e infiltración de linfocitos y apoptosis (52). Los biomarcadores vasculares inducidos por radiación incluyen señales inflamatorias, marcadores de activación y adhesión endoteliales y marcadores protrombicos (48, 120, 121), similares a los reportados para COVID-19.
A partir del 10 de septiembre de 2020, la FDA ha autorizado EUA para más de 150 pruebas de diagnóstico molecular individuales para SARS-CoV-2. Como muestreo, desde el 4 de febrero de 2020 hasta el 18 de junio de 2020, un total de 85 pruebas recibieron la autorización eua, que incluyó 37 pruebas para la detección de ácidos nucleicos del SARS-CoV-2 y una prueba de diagnóstico de antígenos, con las condiciones requeridas para los fabricantes y laboratorios autorizados.6 Del mismo modo, a mediados de junio de 2020, la FDA había autorizado más de 20 pruebas de biomarcadores serológicos, con la advertencia de «siempre consultar las instrucciones completas de uso para poner estas estimaciones en el contexto adecuado y comprender cómo usar e interpretar estas pruebas». El 2 de junio de 2020, la FDA autorizó la única prueba de diagnóstico in vitro para el manejo de pacientes con COVID-19, que se basa en medir los niveles circulantes de IL-6 en estos pacientes. En marcado contraste, ninguna prueba de biodosimetría de radiación ha sido aprobada / autorizada por la FDA.
PATOLOGÍA
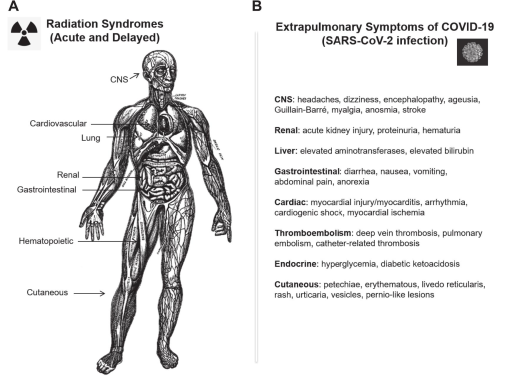
A medida que se dispone de más información, es cada vez más evidente que COVID-19 no es solo una afección pulmonar, sino una enfermedad multiorgánica. Curiosamente, muchos síntomas, así como la patogénesis subyacente en esta lesión multiorgánica causada por el SARS-CoV-2 son similares a la lesión multiorgánica causada por la exposición aguda a la radiación ionizante. En un incidente nuclear, todo el cuerpo de una persona puede estar expuesto a grandes dosis de radiación ionizante dañina, mientras que el SARS-CoV-2 solo puede infectar células que coexpresan la enzima convertidora de angiotensina 2 y la serina proteasa 2 transmembrana (TMPRSS2). La presencia de estas proteínas en una amplia variedad de tipos de células en todo el cuerpo, como las células epiteliales de las vías respiratorias, las células epiteliales alveolares, los macrófagos pulmonares y las células endoteliales vasculares (122, 123), los enterocitos absorbentes del íleon y el colon (124), explica el daño generalizado causado por la infección (124 ). De hecho, el ARN del SARS-CoV-2 se ha detectado en esputo, hisopos nasales, saliva, heces, sangre, lágrimas, orina y líquido cefalorraquídeo (125-128). A pesar de las diferencias en la causa inicial de la lesión, la inflamación sistémica y la coagulopatía, incluida la coagulación intravascular diseminada (CID) son características distintivas tanto de COVID-19 (123, 129-131) como de lesión aguda por radiación, con piroptosis (51, 53, 131, 132) y trampas extracelulares de neutrófilos (133, 134 ) encontrado en ambos. Como se señaló en pacientes con COVID-19, los pacientes con ARS hematopoyético desarrollan linfopenia, trombocitopenia y neutropenia debido al daño de la médula ósea (135), lo que posiblemente contribuya aún más al daño multiorgánico y la falla. Estos procesos de enfermedad que se encuentran tanto en COVID-19 como en los síndromes de radiación aguda y retardada pueden causar directamente o exacerbar aún más las lesiones y la patogénesis en múltiples sistemas de órganos (Fig. 1). De hecho, recientemente se ha descrito el síndrome inflamatorio multisistémico en niños con COVID-19 y afecta a una amplia gama de órganos y sistemas (136).
FIGURA 1
Panel A: Esquema que muestra los sistemas de órganos humanos afectados por la exposición a la radiación y comprende los síndromes de radiación aguda y retardada (Publicado y modificado con permiso; con licencia de ClipArt ETC: https://bit.ly/3mHcyvG). Panel B: Una lista representativa de los síntomas extrapulmonares observados en COVID-19 (infección por SARS-CoV-2) (353). Imagen de coronavirus publicada y modificada, con permiso, de la Facultad de Medicina de la Universidad de Virginia (https://at.virginia.edu/32MutJv).
La enfermedad pulmonar y los síntomas son la presentación más común de COVID-19 y la insuficiencia respiratoria es la causa más común de muerte en aquellos con enfermedad COVID-19 (98, 137),
mientras que el daño pulmonar en pacientes irradiados es un efecto posterior (en comparación con las manifestaciones hematológicas y gastrointestinales). Sin embargo, estas lesiones también pueden ser graves y llevar a la muerte (138, 139).
La neumonitis y la posterior disminución de los niveles de oxígeno en sangre se observan en pacientes con COVID-19 (98, 123, 140), así como después de la irradiación, que a menudo progresa a fibrosis pulmonar (36, 139).
Al igual que con el daño pulmonar observado en pacientes con COVID-19, la fibrosis también se observó en el seguimiento a largo plazo de pacientes con síndrome respiratorio de Oriente Medio (MERS) (141). Se observa un aumento de neutrófilos locales, citoquinas y otros factores inmunitarios en pacientes con COVID-19 con daño pulmonar (32, 33), y también en pacientes y modelos animales de exposición aguda a la radiación (34-36). Estos factores también pueden contribuir a la neumonitis y proporcionar un apoyo adicional a la hipótesis de que la lesión pulmonar observada en pacientes con COVID-19 puede progresar a fibrosis pulmonar.
Si bien los síntomas pulmonares son los más comunes en pacientes con COVID-19, los síntomas gastrointestinales también son comunes.
Las náuseas, los vómitos y la diarrea son síntomas comunes tanto en pacientes con COVID-19 como en pacientes irradiados.
En un estudio publicado de 651 pacientes en China, se encontró que el 11,4% de los pacientes experimentaron al menos un síntoma gastrointestinal (142), mientras que en otro estudio, el 5% y el 3,8% de los pacientes hospitalizados con COVID-19 experimentaron náuseas / vómitos y diarrea, respectivamente (143). Además, el ARN del SARS-CoV-2 se encuentra a menudo en muestras de heces de pacientes con y sin síntomas gastrointestinales (144), lo que no es sorprendente dado que ACE2 se expresa en todos los intestinos y se coexpresa con TMPRSS2 en enterocitos en el íleon y el colon (124). Además, recientemente se descubrió que el SARS-CoV-2 infecta enterocitos in vitro (145).
El daño intestinal y los síntomas observados en COVID-19 no parecen ser tan extremos como los observados en GI-ARS, donde las células madre criptas mueren, lo que lleva a la pérdida de la función e integridad GI, causando no solo náuseas, vómitos y diarrea, sino también hemorragia, endotoxemia, infección bacteriana e incluso la muerte (34, 146).
Sin embargo, la participación de la microbiota intestinal no debe pasarse por alto en ninguno de los procesos de la enfermedad. Si bien aún no se conoce el efecto de la infección por SARS-CoV-2 en el microbioma intestinal,
un microbioma intestinal saludable puede haber contribuido a una respuesta inmune exitosa, pero no demasiado inflamatoria, y a una recuperación acelerada con otras enfermedades respiratorias (147).
Curiosamente, se ha demostrado que los trasplantes de microbiota fecal aumentan la supervivencia en un modelo de ratón de irradiación letal (148).
Otro órgano de preocupación es el corazón. Aunque la coagulopatía observada tanto en COVID-19 como en ARS puede contribuir a la miocardiopatía y la insuficiencia circulatoria, la remodelación directa del tejido cardíaco también se observa en ambos procesos de la enfermedad.
Se han observado isquemia cardíaca, inflamación, fibrosis y engrosamiento de la pared en pacientes con COVID-19 (149, 150) y después de la irradiación, aunque dependen de la dosis y el tiempo después de la irradiación (151, 152).
La infección por SARS-CoV-2 y la radiación aumentan el riesgo de infarto de miocardio, y un estudio de China informó que el 7% de los casos de muerte solo tenían daño miocárdico e insuficiencia circulatoria sin insuficiencia respiratoria (137).
Los estudios de sobrevivientes de la bomba atómica han demostrado que el riesgo de enfermedad cardiovascular aumenta un 14% por Gy de exposición (153). Los efectos a corto y largo plazo del daño cardíaco de ambos procesos de la enfermedad son una preocupación.
Además, se han observado síntomas que indican daño al sistema nervioso central en pacientes con COVID-19 y aquellos con ARS.
Se han notificado casos de dolor de cabeza, desorientación, disfunción cognitiva, ataxia, convulsiones, pérdida del conocimiento, así como otros síntomas en pacientes que recibieron radiación letal en dosis altas (135) y en pacientes adultos y juveniles con COVID-19 (126, 154, 155).
La radiación causa daño vascular e inflamación que conduce a hemorragia y edema (156) y puede aumentar el riesgo de accidente cerebrovascular (157).
Del mismo modo, el daño cerebral en COVID-19 podría deberse a una respuesta inflamatoria sistémica y coagulopatía, lo que lleva a un accidente cerebrovascular y otros problemas (158), o puede deberse directamente a la infección del tejido cerebral, ya que se ha encontrado ARN del SARS-CoV-2 en el líquido cefalorraquídeo y en el tejido cerebral después de la autopsia (159). El daño cerebral debido a la infección o irradiación por SARS-CoV-2 puede iniciar o exacerbar la lesión de otros órganos, incluida la insuficiencia respiratoria o circulatoria (159). Además, existe cierta evidencia de que la exposición a la radiación puede causar problemas psicológicos a largo plazo (160), y dadas las similitudes entre la inflamación del sistema nervioso central inducida por la radiación y la coagulopatía y la observada en COVID-19, es posible que se produzcan efectos neurológicos y psicológicos a largo plazo.
Varios estudios publicados han esbozado las manifestaciones cutáneas de COVID-19. Estos síntomas aparecen en diferentes puntos temporales de la progresión de la enfermedad, ya sea al inicio de la enfermedad o después de la hospitalización (161), y dependen de la gravedad (leve o grave) de la infección (162-164).
Los síntomas más comunes identificados en pacientes con infecciones leves son erupciones similares al sabañón (es decir, dedos de manos o pies COVID) y erupciones petequias / purpúricas, mientras que los pacientes con infecciones graves experimentan síntomas como acroisquemia con cianosis de dedos de manos y pies, ampollas cutáneas, gangrena seca, erupción similar a la varicela y lesiones maculopapulares (162 ).
Al igual que COVID-19, las manifestaciones cutáneas del ARS dependen del punto de tiempo y la gravedad de la exposición que a menudo se evalúan utilizando una escala graduada establecida por el Instituto Nacional del Cáncer (165). Los síntomas más comunes son también los menos graves, es decir, dermatitis aguda por radiación y eritema leve, y se observan en pacientes expuestos a dosis bajas de radiación. Estas complicaciones generalmente se presentan dentro de los 90 días posteriores a la exposición a la radiación (165).
También pueden ocurrir telangiectasias inducidas por radiación, queratosis, úlceras, hemangiomas, hemorragias por astillas en el lecho ungueal distal, hiperpigmentación lentiginosa y fibrosis subcutánea grave.
La exposición a dosis altas de radiación conduce a síntomas graves como descamación húmeda y ulceración (165). Cabe destacar que estas o similares lesiones pueden ocurrir en el epitelio oral tanto en COVID-19 (166, 167) como después de la exposición a la radiación (168). Al comparar las manifestaciones cutáneas relacionadas con COVID-19 y ARS, los síntomas asociados con ARS son más graves y duraderos. Los efectos retardados se pueden ver de meses a años después de la irradiación, mientras que las lesiones debidas a la infección por COVID-19 parecen sanar más rápidamente, generalmente en unos pocos días (161, 169). Por otro lado,
las complicaciones vasculares asociadas con la infección por COVID-19 se parecen mucho a las quemaduras leves por radiación observadas en pacientes que han estado expuestos a dosis leves (no letales) de radiación.
Tanto en COVID-19 como en la lesión cutánea por radiación leve, la lesión vascular puede contribuir aún más a la lesión cutánea, y el daño a la vasculatura en las capas superiores de la piel puede estar involucrado (162, 163, 169).
Otras superposiciones sintomáticas entre COVID-19 y la exposición a la radiación incluyen: lesión renal aguda (72, 170-172), ya sea relacionada con la coagulopatía o directa, ya que las células del túbulo renal son un objetivo potencial para el SARS-CoV-2 (173); lesión hepática, aunque más grave y posiblemente fibrótica en la hepatitis por radiación (174) en comparación con la elevación generalmente leve de los niveles de aspartato aminotransferasa y alanina aminotransferasa observada en el 14-53% de los pacientes con COVID-19 (175); y conjuntivitis (127, 176, 177), un efecto inmediato de la radiación con posibles efectos a largo plazo que incluyen degeneración macular y cataratas (178, 179). Se han observado problemas de fertilidad en individuos irradiados, y también existe preocupación con respecto a la fertilidad masculina en pacientes con COVID-19, ya que los receptores ACE2 también se expresan en los testículos, y algunos pacientes masculinos han informado molestias escrotales. Sin embargo, el SARS-CoV-2 aún no se ha encontrado en el semen, y esta enfermedad aún puede ser demasiado nueva para identificar problemas de fertilidad (180). Se han documentado altas tasas de alopecia androgenética en pacientes hospitalizados con COVID-19, lo que lleva a la hipótesis de que el uso de la terapia antiandrógena (flutamida) puede ser un posible tratamiento para los pacientes con COVID-19 (181).
Las coagulopatías inducidas por radiación (RIC) forman parte del continuo de las secuelas de irradiación (134, 182, 183), con paralelos a la CID. La hemorragia, un sello distintivo de la CID, se notificó en el 60% de las muertes en la población expuesta a la bomba A, acompañada de lesiones petequiales y trombocitopenia (184), y también se observó después (184), así como otros accidentes por radiación (185, 186). Se observó prevalencia de tiempos prolongados de formación de coágulos, aumento de los niveles de complejo trombina-antitrombina III (TAT) y aumento de los niveles circulantes de nucleosomas/histonas (cNH) en sangre de muestras clínicas irradiadas (134). El dímero D no se ha reportado en ninguno de los estudios de coagulopatía relacionada con la radiación, pero otras métricas utilizadas para predecir la coagulopatía para COVID-19 son similares a la RIC.
Aunque en muchos sistemas el daño por radiación es mucho más grave y crónico, en general, las similitudes observadas hasta ahora entre COVID-19 y ARS / DEARE pueden proporcionar información sobre los efectos tardíos de COVID-19, así como arrojar luz sobre posibles objetivos para diagnósticos, marcadores pronósticos y terapias.
CONTRAMEDIDAS MÉDICAS
Como se señaló,
existen claros paralelismos entre la exposición a la radiación, que se sabe que actúa sistémicamente para causar daño, y COVID-19, que se ha implicado en daños en órganos que van desde el pulmón y el tracto gastrointestinal hasta el corazón, el cerebro, el riñón y la vasculatura.
De hecho,
las características de la neumonitis inducida por radiación son similares a la neumonía intersticial por SARS-CoV-2 (187).
Por lo tanto, no es sorprendente que haya una serie de tratamientos para la exposición a la radiación en desarrollo que podrían resultar eficaces para COVID-19. Debido a que no es posible «combatir» la radiación en un sentido convencional, de la manera en que es posible desarrollar enfoques dirigidos directamente a un patógeno, los investigadores se han basado en la modificación de la respuesta del huésped a la lesión, para identificar terapias para abordar el daño causado por la exposición a la radiación. En muchos casos, estos enfoques han funcionado aprovechando la inmunidad innata del cuerpo, que a menudo está desregulada por la exposición a la radiación.
Estos tratamientos se dividen en varias categorías generales, que incluyen antioxidantes, antiinflamatorios, antibióticos, antifibróticos, factores de crecimiento, terapias celulares y productos que se dirigen a la vasculatura o al RAS.
Especialmente importante destacar es la capacidad de reutilizar este tipo de medicamentos establecidos, algunos de los cuales ya están en uso clínico, para acelerar su uso en pacientes con infección por SARS-Cov-2. Estos diversos enfoques se examinarán por separado a continuación, de acuerdo con sus mecanismos de acción.
Factores de crecimiento
Covid-19 se caracteriza por el daño al pulmón y la vasculatura, reduciendo la oxigenación de la sangre.
En una revisión de los efectos de la eritropoyetina (EPO), Ehrenreich et al. (188) señaló que la EPO actúa sobre los tejidos más allá de la eritropoyesis; estos efectos podrían tenerse en cuenta en la lucha contra la patología del SARS-CoV-2. La EPO se produce en el cuerpo en respuesta a los bajos niveles de oxígeno y, a corto plazo, se une a los receptores en el tronco encefálico para mejorar la ventilación mecánica. La EPO también actúa sobre las vías respiratorias y la vasculatura pulmonar para reducir la inflamación y promover la vascularización y se ha demostrado clínicamente que es neuroprotectora. Aunque al momento de escribir este artículo, no se han iniciado ensayos, se ha propuesto un ensayo aleatorizado controlado con placebo para la prueba de concepto. También se ha demostrado que la EPO acelera la expansión de progenitores eritroides en modelos de irradiación de ratón (189, 190). Galal et al. (191) describió los efectos de la EPO más allá de la eritropoyesis, a través de la reducción del estrés oxidativo mediante la regulación al alza de los receptores antiinflamatorios. Estas actividades apuntan a posibles tratamientos para reducir la inflamación que contribuye a la lesión gastrointestinal, pulmonar o renal inducida por la radiación.
Leucina (sargramostim o factor estimulante de colonias de granulocitos-macrófagos, GM-CSF; Partner Therapeutics Inc., Lexington, MA) es uno de los tres factores de crecimiento de leucocitos aprobados por la FDA de los Estados Unidos para el tratamiento del ARS (192). Lang et al. (193) señaló que, al igual que la estimulación del sistema inmunitario puede ayudar al cuerpo a combatir una infección viral o producir una respuesta inflamatoria perjudicial, la administración o inhibición de GM-CSF puede ser una terapia útil para COVID-19. Los macrófagos pulmonares dependen de la producción alveolar de GM-CSF para su mantenimiento, y la administración de GM-CSF podría proporcionar protección contra la infección viral en las primeras etapas del SDRA y promover la reparación de tejidos. Al momento de escribir este artículo, sargramostim se propone como terapéutico contra COVID-19 en tres ensayos.®7 (NCT04400929, NCT04326920, NCT04411680). En cuanto a los efectos nocivos, el GM-CSF puede exacerbar la respuesta inflamatoria, impulsando patologías pulmonares como las resultantes de COVID-19. En este caso, la inhibición de GM-CSF podría reducir la expresión de las citoquinas proinflamatorias IL-1, IL-6 y TNF, proporcionando un enfoque múltiple para amortiguar un sistema inmunológico sobreestimulado. Los tratamientos con anticuerpos monoclonales dirigidos al receptor GM-CSF o GM-CSF que están en curso incluyen: otilimab (NCT04376684), gimsilumab (NCT04351243), lenzilumab (NCT04351152), TJM2 (NCT04341116) y mavrilimumab (NCT04397497, NCT04399980, NCT04447469). Namilumab se está utilizando en la clínica en un programa de acceso ampliado. Los pacientes que reciben tratamiento en estos protocolos experimentales deberán ser monitoreados cuidadosamente debido al papel que desempeña gm-CSF en la homeostasis inmunológica. Además, parece que el momento de este tipo de intervenciones con factores de crecimiento es fundamental para su eficacia potencial.
Enfoques antioxidantes
El daño inducido por la radiación se caracteriza por aumentos en las especies reactivas de oxígeno (ROS) y estrés oxidativo (194-196).
Estos aumentos, y la respuesta inflamatoria resultante, pueden dañar otros tejidos sensibles (197-200).
Se ha demostrado que el antioxidante N-acetil cisteína (NAC) mitiga el daño inducido por la radiación en el tracto gastrointestinal y mejora la supervivencia a los 10 y 30 días en ratones que reciben irradiación abdominal total (201).
NAC también disminuyó el daño de la médula ósea fuera del campo y los niveles de ROS, lo que sugiere que el daño de la médula ósea contribuye a parte de la lesión gastrointestinal inducida por la radiación. Debido a patrones similares de daño tisular, Corry et al. se planteó la hipótesis de que el daño pulmonar inducido por COVID-19 también podría mejorarse con el tratamiento con NAC (202). Esta hipótesis fue respaldada por un hallazgo anterior de que el tratamiento con NAC de pacientes con lesión pulmonar aguda y SDRA resultó en una reducción de la mortalidad (203). Actualmente, hay varios ensayos clínicos nacionales en curso para abordar el posible beneficio del tratamiento con NAC en pacientes con COVID-19 (NCT04374461, NCT04419025, NCT04370288 y NCT04279197).
Otro compuesto bajo investigación para COVID-19 es el antagonista del receptor H2 de histamina famotidina. Típicamente utilizado para tratar el reflujo ácido y la acidez estomacal, el medicamento también se sabe que tiene actividad antioxidante (204). Aunque es un candidato poco probable para tratar enfermedades virales, la famotidina llamó la atención de los investigadores interesados en reutilizar productos ya autorizados (205). Los medicamentos genéricos y no patentados eran de particular interés debido a su seguridad y asequibilidad, respaldados por amplios datos en humanos (206). Además, el análisis in silico sugirió que el fármaco podría ser útil como alternativa terapéutica en COVID-19 (207). Los médicos han observado que los pacientes hospitalizados que tomaron el medicamento para otras indicaciones médicas parecieron recuperarse de COVID-19 mejor que aquellos que no tomaron el medicamento (208). Una revisión de más de 6,000 registros de pacientes sugirió que el uso de famotidina condujo a una tasa de mortalidad de ∼ 14%, en comparación con el 27% para aquellos que no habían tomado famotidina. Este hallazgo fue respaldado además por un análisis retrospectivo de pacientes con COVID-19 que recibieron el medicamento dentro de las 24 h posteriores al ingreso hospitalario, que mostró que su uso redujo el riesgo de intubación o muerte (209). Un mecanismo de acción sugerido de la famotidina es una acción directa sobre el receptor, lo que lleva a una mejor regulación de los mastocitos (210). Se están llevando a cabo ensayos clínicos prospectivos adicionales para analizar la eficacia del medicamento en pacientes con COVID-19 (NCT04370262, NCT04389567). Un artículo publicado recientemente ha sugerido que la famotidina es ineficaz; sin embargo, los autores afirman que «No estamos desafiando que la famotidina pueda ayudar. Estamos diciendo que el mecanismo de acción no es antiviral».8 Esto es consistente con el principal mecanismo de acción antioxidante propuesto.
Los investigadores de radiación también han tratado de comprender los efectos protectores de la administración de famotidina, con respecto a la limitación del daño al ADN y la protección celular. Con estudios realizados in vivo, tanto en modelos de irradiación preclínica como en pacientes sometidos a radioterapia, se han demostrado los beneficios potenciales del fármaco. Se encontró que la famotidina era radioprotectora en ratones a los que se les administró el fármaco antes de la irradiación, según lo evaluado por la formación de micronúcleos en células de la médula ósea (211, 212). El trabajo preclínico con leucocitos de ratón recolectados de animales irradiados documentó resultados consistentes, con reducciones en el daño al ADN en animales tratados con famotidina antes de la irradiación (213). La famotidina también redujo significativamente la linfocitopenia en pacientes con cáncer de próstata que recibieron el medicamento unas horas antes de someterse a radioterapia (214). En otro estudio, los pacientes con cáncer de próstata que recibieron dosis orales dos veces al día de famotidina durante su radioterapia condujeron a una reducción en la lesión inducida por la radiación en el tejido rectal normal (215). Estos hallazgos clínicos en pacientes con cáncer se basaron en trabajos anteriores utilizando muestras de sangre periférica tomadas de voluntarios sanos normales (216). En esos estudios, la sangre fue irradiada ex vivo en presencia o ausencia de vitamina C y famotidina. Los resultados del ensayo Comet sugirieron que la presencia de famotidina era protectora para la apoptosis inducida por radiación, con un factor de reducción de dosis estimado de 1,5. Los efectos protectores del medicamento mencionados anteriormente sugieren que el medicamento puede tener un efecto antioxidante y la capacidad de eliminar los radicales libres, un mecanismo que justificaría el uso clínico del medicamento para COVID-19.
Enfoques antiinflamatorios
La COVID-19 grave se caracteriza por una tormenta de citoquinas, indicativa de una respuesta inmune hiperactiva a la infección (217).
Debido a que los niveles elevados de citoquinas proinflamatorias se asocian con una alta morbilidad y mortalidad, se han propuesto varios enfoques para modular la respuesta inflamatoria. Específicamente, COVID-19 resulta en niveles elevados de IL-6 sérica (217). El antagonista del receptor de IL-6, tocilizumab (Actemra, Genentech, San Francisco, CA), indicado para la artritis reumatoide, también se ha propuesto para mejorar el daño tisular inducido por la radiación, y ha demostrado eficacia en la disminución de la tormenta de citoquinas resultante de la inmunoterapia contra el cáncer (218). En los primeros estudios clínicos publicados para evaluar el impacto potencial del tratamiento con tocilizumab en COVID-19, Somers et al. (219) realizó un ensayo de un solo sitio del fármaco en 154 pacientes con COVID-19 con ventilación mecánica. Los tratamientos resultaron en un menor riesgo de muerte, aunque la tasa de superinfecciones aumentó. Antinori et al. (220) señaló el riesgo de una infección secundaria por Candida por el tratamiento con tocilizumab y, por lo tanto, sugirió que el fármaco solo se utilizara en ensayos clínicos bien diseñados. Actualmente, se ha incluido un brazo de tratamiento con tocilizumab como parte del ensayo de Evaluación Aleatoria de la Terapia COVID-19 (RECOVERY) de la Universidad de Oxford,®9 cuyos resultados no se hayan facilitado en el momento de redactar este informe. En un estudio que analizó el efecto del fármaco en pacientes críticamente enfermos, el tratamiento condujo a una mejor oxigenación y recuentos sanguíneos (221). Además, otro anticuerpo anti-RECEPTOR DE IL-6, sarilumab (Kevzara; Regeneron Pharmaceuticals Inc., Tarrytown, NY y Sanofi, París, Francia) también está bajo consideración clínica en más de 10 ensayos registrados como tratamiento para pacientes con COVID-19 en etapa tardía.®
La dexametasona es un medicamento corticosteroide genérico, que está autorizado para una amplia gama de indicaciones que incluyen artritis, reacciones alérgicas y trastornos del sistema inmunológico. Se ha demostrado que la dexametasona reduce el daño multiorgánico, incluida la lesión pulmonar, en ratas que han estado expuestas a radiación localizada (222). En modelos de primates no humanos (NHP) de lesión pulmonar inducida por radiación, la dexametasona se ha utilizado como un componente del tratamiento médico, donde se administra cuando hay un aumento en la frecuencia respiratoria no sedada, lo que sugiere dificultad respiratoria (138, 223, 224). Este uso del fármaco es similar a su uso clínico para la disnea (225). En estos estudios de NHP, el tratamiento con dexametasona redujo la frecuencia respiratoria elevada, la densidad pulmonar, el derrame pleural y la neumonitis, lo que condujo a mejores resultados. El tratamiento con dexametasona también se ha incluido como brazo en el ensayo RECOVERY (226), donde se ha demostrado que su uso reduce la mortalidad por COVID-19 del 40,7% al 29% entre los pacientes que requirieron ventilación mecánica invasiva, pero no pareció conferir un beneficio a los pacientes hospitalizados que recibieron solo oxígeno.
Estos datos sugieren que el tratamiento con corticosteroides solo puede ser efectivo si el sistema inmunitario está sobreestimulado en la medida en que está causando un daño significativo.
El Grupo de Trabajo de Evaluación Rápida de la Evidencia de la OMS para terapias covid-19 realizó un metanálisis de siete ensayos aleatorios y concluyó que los corticosteroides sistémicos redujeron la mortalidad por todas las causas a los 28 días (227). Otro tratamiento que se ha demostrado que mejora la supervivencia en un modelo de ratón de lesión pulmonar inducida por radiación es BIO 300 (Humanetics Corp., Edina, MN), que es una nanosuspensión del isoflavonoide de soja, genisteína. En ratones, la administración de BIO 300 mejoró la supervivencia y redujo otras morbilidades causadas por la irradiación pulmonar (228). Aunque la genisteína tiene actividad antiviral (229–231), también puede ser útil para prevenir el daño pulmonar inducido por la radiación. Se cree que la genisteína actúa a través de la inactivación de NF-κB (232), y dado que se ha demostrado que la inhibición de NF-κB reduce la inflamación en un modelo de ratón de COVID-19, podría ser eficaz en el tratamiento de las complicaciones pulmonares causadas por la infección por SARS-CoV-2. Humanetics ha anunciado el inicio de un ensayo clínico en pacientes con COVID-19 dados de alta, para determinar si el tratamiento con el producto oral BIO 300 puede reducir la fibrosis pulmonar tardía y mejorar la calidad de vida en pacientes que se están recuperando de la infección (NCT04482595).
Dado que la enfermedad autoinmune, la artritis reumatoide (AR) es causada por una respuesta inmune hiperactiva que se dirige al tejido articular normal, no es sorprendente que se estén considerando enfoques que han demostrado beneficios en la AR para COVID-19. Por ejemplo, anakinra (Kineret; Swedish Orphan Biovitrum AB, Estocolmo, Suecia), un antagonista específico del receptor de IL-1, se ha propuesto como un posible tratamiento. Del mismo modo, se ha informado que anakinra reduce la inflamación vascular en un modelo de ratón de exposición a la radiación (233). En ese estudio, la administración del fármaco durante dos semanas después de la irradiación redujo la expresión de mediadores inflamatorios como la pro-caspasa y la caspasa-1. En un informe de caso temprano de Italia, los médicos describieron a un paciente gravemente enfermo que fue tratado con éxito con anakinra (234). Desde entonces han seguido otros estudios; de hecho, King et al. han descrito diez ensayos clínicos en curso que se dirigen a la hiperinflamación. Está claro que se están probando muchos regímenes de dosificación diferentes y que la mayoría de estos estudios más pequeños (<400 pacientes) deben considerarse preliminares, pero los datos que surgen de estos estudios podrían conducir a estudios a mayor escala con tratamientos más uniformes. Se han publicado los resultados de algunos de estos estudios de anakinra. En el estudio anakinra-COVID realizado en Francia, el 25% de los pacientes que fueron tratados con anakinra requirieron ventilación mecánica invasiva o murieron, en comparación con el 44% de los controles históricos del mismo hospital (235). En otro pequeño estudio de cohorte retrospectivo de Italia, parte del estudio del Biobanco COVID-19, los pacientes tratados con anakinra mostraron una mejoría en los parámetros respiratorios (menor necesidad de oxígeno suplementario, mejora de la PaO®2/FiO2 y reducciones en el marcador inflamatorio, proteína C reactiva.
Enfoques antifibróticos
La inflamación pulmonar causada por la radiación puede progresar a fibrosis en etapas posteriores de la lesión, causando dificultad para respirar y reducción de la saturación de oxígeno en la sangre.
Los medicamentos actualmente aprobados para tratar la fibrosis pulmonar incluyen nintedanib (OFEV; Boehringer Ingelheim, Ingelheim am Rhein, Alemania) y pirfenidona (Esbriet; Genentech). Nintedanib es un inhibidor de la tirosina cinasa aprobado para la fibrosis pulmonar idiopática. Utilizando un modelo de ratón de irradiación localizada, los investigadores demostraron que nintedanib protegía contra la fibrosis a largo plazo, como se detectó microscópicamente a las 39 semanas después de la irradiación (236). Del mismo modo, los estudios mostraron protección en un modelo de ratón de irradiación torácica mediante tratamiento con pirfenidona (237).
En términos de COVID-19 y su progresión, se observó que los pacientes que experimentaron SDRA grave a menudo exhiben fibrosis pulmonar posterior (238).
Aunque los tratamientos antiinflamatorios podrían prevenir la enfermedad en etapa tardía, no se sabe si este será el caso para COVID-19. Por esta razón, los autores proponen que los antifibróticos, como los descritos anteriormente, deben estudiarse en ensayos clínicos. En un estudio clínico (NCT04338802), los pacientes serán aleatorizados en un grupo de tratamiento con placebo-control o nintedanib, y en otro, se estudiará la seguridad y eficacia de la pirfenidona en pacientes con infección por SARS-CoV-2 (NCT04282902). Del mismo modo, imatinib (Gleevec; Novartis, Basilea, Suiza), con licencia para la leucemia mieloide crónica,®®®10 y previamente se ha demostrado que aumenta el tiempo de supervivencia de los ratones irradiados al retrasar la enfermedad pulmonar, se ha sugerido como un tratamiento covid-19 (239). Se planifican varios ensayos clínicos (NCT04357613) o reclutan pacientes (NCT04394416) para estudiar el fármaco como un posible tratamiento para la enfermedad.
La pentoxifilina es otro medicamento que potencialmente podría reutilizarse como tratamiento para COVID-19. Originalmente autorizado para tratar el dolor en individuos que sufren de claudicación intermitente (enfermedad arterial periférica),11 la pentoxifilina mejora el flujo sanguíneo, aumentando así la oxigenación de los tejidos. También se ha demostrado que inhibe la síntesis de citoquinas proinflamatorias, específicamente TNF-α (240). Se ha demostrado que la pentoxifilina reduce la lesión fibrovascular inducida por radiación en modelos animales (241) y en la clínica (242). Debido a estas actividades antifibróticas (y antiinflamatorias), la pentoxifilina se ha propuesto como un posible preventivo de las complicaciones de COVID-19 (243) y se probará en un ensayo clínico (NCT04433988). Otro impulsor de la fibrosis pulmonar, el TGF-β (244), presenta un objetivo potencial para la prevención de la fibrosis pulmonar en pacientes con COVID-19 (245). Por ejemplo, un producto de ARNm antisentido que se dirige a la producción de TGF-β2, OT-101 (Mateon Therapeutics, San Francisco, CA), se encuentra en ensayos de fase 3 para varios tipos de cáncer y se ha propuesto como tratamiento contra la COVID-19 (246). Dada la probable participación de TGF-β en la progresión de COVID-19, un producto preclínico, anti-TGFβ receptor 1, IPW5371 (Innovation Pathways, Palo Alto, CA) también puede ser un candidato prometedor para tratar la fibrosis pulmonar inducida por COVID-19, ya que se ha demostrado previamente que reduce la fibrosis y mejora la supervivencia en un modelo de ratón de exposición a la radiación (247).
Enfoques dirigidos a RAS
En las primeras etapas de la pandemia, quedó claro que un método por el cual el virus SARS-CoV-2 obtuvo acceso a la maquinaria celular interna fue a través del receptor ACE2, cuya expresión es más frecuente en las células epiteliales alveolares pulmonares (248). Este hallazgo fue similar al SARS-CoV, que también utilizó el receptor ACE2 para ingresar a las células (249). Por lo tanto, los tratamientos iniciales considerados para los pacientes fueron los inhibidores de la enzima convertidora de angiotensina (IECA) o los bloqueadores de los receptores de angiotensina II (BRA). Debido a que muchos medicamentos, como los inhibidores de la enzima convertidora de angiotensina (IECA), son genéricos y están ampliamente disponibles, representan una opción valiosa en los medicamentos reutilizados. Los beneficios claros incluyen bajo costo, riqueza de experiencia clínica, datos humanos establecidos y efectos secundarios mínimos. Durante las etapas iniciales de la respuesta a la COVID-19, se pensó que las personas que actualmente toman medicamentos hipertensivos podrían tener un mayor riesgo de infección y, por lo tanto, su uso debería suspenderse en pacientes con COVID-19 (250, 251). En un gran estudio retrospectivo de más de 12,000 pacientes, se consideró la relación entre el uso previo de IECA y los resultados de los pacientes después de la infección, con el hallazgo de que no hubo correlación entre el uso previo de medicamentos para la hipertensión y el riesgo de COVID-19 (252).
Además, se hizo evidente que ciertos segmentos de la población tenían más probabilidades de tener formas más graves de enfermedad y una propensión a desarrollar SDRA. Estos individuos incluyeron a aquellos con enfermedades cardiovasculares, diabetes e hipertensión, todos los cuales tienen asociaciones con aspectos desregulados de RAS (253). Otros estudios sugirieron que estos fármacos deberían considerarse como un tratamiento potencial debido a sus efectos múltiples (por ejemplo, antioxidante antiinflamatorio y antifibrótico) (254). Por lo tanto, sigue siendo necesario evaluar tanto los agonistas de la angiotensina como los antagonistas de la COVID-19 (255). En un estudio, se inscribieron pacientes con COVID-19 con hipertensión para explorar si el uso de tratamientos con IECA o antagonistas de los receptores de angiotensina afectaría la gravedad y la progresión de la infección (256). Como biomarcador de eficacia, también se evaluaron los niveles séricos de IL-6 y los recuentos de células T circulantes. Se encontró que ambos tratamientos aumentan las células T, disminuyen la carga viral y los niveles de IL-6, y reducen la gravedad del curso de la enfermedad. Por lo tanto, se hizo la recomendación de mantener los tratamientos con IECA y bloqueadores de los receptores de angiotensina en pacientes con COVID-19.
Del mismo modo, la comunidad de radiación ha establecido el papel que los productos dirigidos a RAS pueden desempeñar en la progresión de las lesiones de órganos inducidas por la radiación, principalmente el pulmón y los riñones. Muchos estudios han demostrado la capacidad de los productos de IECA para tratar las lesiones pulmonares inducidas por la radiación. Realizado principalmente en modelos de lesión en ratas, se encontró que los IECA aumentan la supervivencia y disminuyen el daño pulmonar, renal y vascular (257, 258). Estos hallazgos fueron consistentes en diferentes métodos de exposición a la radiación, como TBI más trasplante de médula ósea (TMO), irradiación pulmonar de tórax completo (WTLI) o irradiación parcial del cuerpo (PBI) con un porcentaje de la médula ósea salvada mediante blindaje (259). La mitigación de las lesiones pulmonares y renales se determinó mediante la evaluación de los marcadores circulantes de daño renal (por ejemplo, nitrógeno ureico en sangre y creatinina) y las imágenes por TC de los pulmones en animales irradiados. En un modelo de rata irradiada, captopril y fosinopril aumentaron la supervivencia después de 11 Gy (LCT con TMO) y disminuyeron la lesión pulmonar (257). Del mismo modo, se encontró que el lisinopril mitiga el daño renal (260) y pulmonar (259) después de dosis altas de PBI en ratas adultas y mejora la supervivencia en ratas juveniles y geriátricas (38). Enalapril mitigó la lesión y mejoró la supervivencia en un modelo de rata WTLI, incluso cuando se inició 35 días después de la irradiación (261). El captopril, administrado en un modelo de LCT, mejoró la supervivencia, aunque ese beneficio disminuyó cuando se combinó con un traumatismo cutáneo (262). Finalmente, el ramipril mitigó el daño inducido por la radiación a la médula espinal (263). En otros modelos preclínicos de lesión por radiación, la angiotensina (1-7) [A(1-7)], un componente del RAS mencionado anteriormente, también se ha estudiado por su capacidad para mejorar la supervivencia en roedores irradiados (264, 265). Estos péptidos, que se ha demostrado que alteran la actividad en muchos tipos de células, aceleraron la recuperación de la médula ósea en ratones que recibieron LCT y también mejoraron el nadir plaquetario en los animales (264). En estudios posteriores, los péptidos de angiotensina, incluso cuando se administraron días después de la irradiación letal, mejoraron la supervivencia del ratón y redujeron el tiempo de sangrado (265).
Enfoques dirigidos a la vasculatura
La capacidad del virus para infectar y desregular directamente las células endoteliales (41) es la fuerza impulsora detrás de las coagulopatías vasculares y las trombosis observadas en pacientes con COVID-19.
Además de los efectos vasculares resultantes de la infección viral directa, se ha encontrado que los pacientes con COVID-19 tienen niveles más altos de VEGF en comparación con los controles sanos (266). El VEGF elevado podría aumentar aún más la permeabilidad de los vasos, lo que lleva a algunos de los síntomas observados en los pacientes. Además, los estudios han implicado al VEGF como un objetivo para la intervención terapéutica en el SDRA (267). En el momento de escribir este artículo, se están planificando o se están reclutando varios ensayos clínicos de pacientes con COVID-19 para evaluar la eficacia potencial de bevacizumab, un anticuerpo monoclonal humanizado anti-VEGF, de larga duración, como tratamiento para el SDRA asociado a COVID-19 (NCT04275414, NCT04344782, NCT04305106). También conocido como Avastin, el mecanismo de acción del fármaco es unirse al VEGF extracelular y prevenir su interacción con su receptor en las células endoteliales (268).®
Durante mucho tiempo se sabe que la exposición a la radiación conduce a un deterioro vascular, lo que se cree que explica la disfunción multiorgánica que causa (121).
Muchos enfoques clínicos prometedores que se dirigen a la vasculatura podrían tener un efecto sobre el daño inducido por la radiación. VEGF también representa una molécula que está involucrada en la exposición a la radiación y, por lo tanto, es un objetivo para reducir los efectos negativos. Por ejemplo, se ha demostrado que los niveles de VEGF aumentan en ratones después de la irradiación (269, 270), y los niveles elevados del factor de crecimiento se han implicado en el desarrollo de necrosis inducida por radiación del tejido normal (271). Se ha demostrado que los anticuerpos anti-VEGF (bevacizumab) mitigan la necrosis por radiación en cerebros de ratón (272) y en ratas que se sometieron a radiocirugía con bisturí de rayos gamma (273), y bevacizumab se ha utilizado en la clínica para la lesión por radiación, donde se encontró que reduce la necrosis en pacientes con carcinoma nasofaríngeo que recibieron radioterapia (274).
A medida que se continúan haciendo observaciones en pacientes con COVID-19, se ha hecho evidente que la CID puede ser responsable de muchas de las complicaciones que se han visto (275-278).
Esta condición, que se caracteriza por el desarrollo y la circulación de pequeños coágulos de sangre, puede conducir a la obstrucción de los vasos pequeños.
Como efecto de seguimiento, el consumo anormal de plaquetas puede, a su vez, conducir a trombocitopenia y hemorragia (279).
En varios modelos animales de exposición letal a la radiación, incluidos hurones (280) y minipigs de Yucatán (281), ha habido evidencia de CID, tanto en los primeros días después de la irradiación como en el momento de la muerte. Se cree que la CID podría contribuir a la mortalidad humana inducida por radiación (50), ya que la hemorragia en el momento de la muerte se ha observado clínicamente en pacientes irradiados. Un hallazgo importante en las autopsias de humanos que han muerto por exposición a la radiación (282), el sangrado generalizado en los tejidos a menudo ocurre como resultado de la CID. Las anomalías de la coagulación también han surgido claramente como un sello distintivo clave de las infecciones por COVID-19 (283).
Además de las trombosis (284), también se ha observado trombocitopenia en algunos pacientes que experimentan infección por COVID-19.
En un estudio de China en el que participaron más de 1.000 pacientes, el 36,2% eran trombocitopénicos, un hallazgo que fue mayor en los casos más avanzados (98). Esta asociación del bajo recuento de plaquetas con la infección también está respaldada por un metanálisis en el que se examinaron los datos de nueve estudios, con casi 1.800 pacientes (71). Esos investigadores encontraron que los recuentos de plaquetas eran mucho más bajos en pacientes con enfermedad grave y concluyeron que estos recuentos reducidos podrían indicar un mayor riesgo de mortalidad. Se postula que la infección con SARS-CoV-2 conduce a este estado plaquetario desregulado a través de una serie de vías causales diferentes, incluida una reducción en la producción de plaquetas debido a la pérdida de progenitores y la inhibición del crecimiento, un aumento del aclaramiento debido a la evolución de los autoanticuerpos y un mayor consumo de plaquetas debido a una lesión pulmonar, lo que conduce a la activación plaquetaria y la formación de microtrombis (284).
Al igual que COVID-19, se sabe que las exposiciones a la radiación, especialmente la LCT, conducen a una reducción en los niveles de plaquetas. Se ha postulado que esta trombocitopenia desempeña un papel importante en las muertes por exposición (282). Para abordar esta manifestación de lesión por radiación, se han probado medicamentos que promueven la producción de plaquetas y están aprobados por la FDA para otras indicaciones [por ejemplo, púrpura trombocitopénica inmune (PTI)] para ver si podrían mitigar el daño y mejorar la supervivencia. Esto ha incluido estudios preclínicos y clínicos de medicamentos como Nplate (Amgen, Thousand Oaks, CA) (6, 285) y Promacta (Novartis) (286, 287). Aunque hay un informe de caso que documenta el uso de Promacta para tratar a un paciente con COVID-19 que presentó síntomas de PTI mientras estaba hospitalizado (288) y respondió bien al tratamiento, no parece que estas terapias se hayan intentado en una escala más amplia hasta ahora. Esto puede deberse al delicado equilibrio entre trombocitopenia y trombosis en estos pacientes; el momento de las intervenciones es crucial para su eficacia o perjuicio. Según los informes de casos, la heparina se ha administrado como un medio para contrarrestar la hipercoagulación (289), y la Sociedad Internacional de Trombosis y Hemostasia ahora recomienda el uso de heparina para todos los pacientes con COVID-19 (290). Claramente, las decisiones clínicas sobre el uso de tratamientos que mejoran los recuentos de plaquetas o buscan reducir la coagulación son complejas, y el uso de este tipo de tratamientos representa un área de gran interés. TP508, un péptido de 23 aminoácidos que es una forma truncada de protrombina humana, también se ha demostrado que mitiga la lesión tisular normal por radiación y aumenta la supervivencia en un modelo de LCT (LD100/15) de ratón (291). En estudio en varios otros modelos preclínicos [por ejemplo, isquemia (292) y lesiones musculoesqueléticas (293), y en ensayos clínicos para tratar las úlceras del pie diabético (294)], se ha demostrado que TP508 mejora la reparación de tejidos al dirigirse a las células endoteliales (292). Este producto se encuentra en pruebas preclínicas tempranas como tratamiento para COVID-19®®12 porque se dirige a la vasculatura como su principal mecanismo de acción y tiene capacidad generalizada para mitigar el daño tisular.
Las estatinas como tratamiento común para la lesión vascular
Las estatinas representan otra área de superposición de tratamiento farmacológico entre la radiación y COVID-19 (295, 296). Además de un efecto antiinflamatorio, las estatinas pueden modificar la entrada de virus en las células, induciendo la autofagia de las células infectadas o alterando la activación de la cascada de coagulación (297). Los estudios in silico sugieren que las estatinas poseen actividad antiviral directa a través del bloqueo de la infectividad (298) y se ha demostrado que mejoran los niveles de ACE2 (299) y protegen contra el SDRA (300).
En ensayos clínicos de pacientes con COVID-19, se sugirió que los beneficios observados superaban su riesgo potencial (301). Un estudio retrospectivo de pacientes tratados con estatinas para otras indicaciones mientras estaban hospitalizados con COVID-19 mostró un menor riesgo de mortalidad (302). En modelos animales de lesión por radiación, las estatinas han demostrado la mitigación del daño a los tejidos normales. Se ha demostrado que la simvastatina, un inhibidor de la HMG-CoA reductasa con uso clínico generalizado, mitiga la lesión pulmonar en un modelo de ratón de irradiación torácica en dosis altas (303) y protege el tracto gastrointestinal, la médula ósea (304) y las glándulas salivales (305). Del mismo modo, la atorvastatina limita el daño cardíaco inducido por la radiación en un modelo de rata (306) y la lesión renal en ratones (308).
Quizás lo más significativo es que, en términos de superposición con un mecanismo de acción primario involucrado en COVID-19, se ha demostrado que la atorvastatina induce una respuesta protectora en las células endoteliales de la vena umbilical humana irradiada (HUVEC) (308). El tratamiento de los HUVEC con atorvastatina disminuyó la apoptosis celular inducida por la radiación, que se cree que es impulsada por la regulación al alza de la trombomodulina y la activación de la proteína C. Finalmente, la lovastatina, cuando se administra después de una irradiación de dosis altas en un modelo de ratón WTLI, aumentó la supervivencia, redujo los niveles de macrófagos y linfocitos en el pulmón y disminuyó el colágeno (309). La proteína C activada (APC) se ha probado por su capacidad para mitigar las lesiones por radiación (310) y ahora se ha propuesto como terapia para la disfunción vascular y la trombosis anormal (por ejemplo, CID) observadas en pacientes con COVID-19 (311). La capacidad de APC para regular a la baja la inflamación y generar trombina indica su potencial para reducir la inflamación y limitar la lesión isquémica en todo el cuerpo.
Tratamientos antibióticos para la radiación o la infección por SARS-CoV-2, más allá de las propiedades antibacterianas
Dada la necesidad de evaluar rápidamente los posibles tratamientos, muchos médicos han recurrido a los antibióticos, que tienen la ventaja de los datos de seguridad y la experiencia clínica.
Se han sugerido varias clases de antibióticos, que tienen actividad contra infecciones bacterianas secundarias y tienen propiedades antiinflamatorias y antivirales, como posibles tratamientos para COVID-19.
El modelado in silico y otros estudios predictivos indican la eficacia de compuestos aminoglucósidos como la estreptomicina (312); tetraciclinas, como doxiciclina (313, 314) y eravaciclina (312); antibióticos macrólidos, como azitromicina (315); estreptograminas, como quinupristina (316); antibióticos ionofóricos de poliéter, como salinomicina (317); y glicopéptidos, como la teicoplanina. Se encontró que la teicoplanina, un medicamento utilizado para tratar las infecciones por estafilococos, es eficaz contra el MERS y se prevé que también sea eficaz contra el SARS-CoV-2 (318, 319). Había esperanza de que la azitromicina, en combinación con hidroxicloroquina (320), podría ser eficaz para reducir la gravedad de las infecciones por SARS-CoV-2 (321). Se cree que el medicamento, comúnmente utilizado para tratar infecciones respiratorias y de otro tipo, fortalece las respuestas antivirales mediadas por interferón (315). Desafortunadamente, los estudios clínicos no proporcionaron evidencia de la eficacia del fármaco (322). En contraste, algunos estudios sugieren un beneficio limitado del uso de antibióticos, ya sea solos o en combinación (323) tanto en niños como en adultos con COVID-19 (324), y otras investigaciones sugieren que el uso de algunos antibióticos en realidad podría empeorar la progresión de la enfermedad (325).
Al igual que con COVID-19, la eficacia de los antibióticos, fuera de su impacto antibacteriano normal, se ha observado en la mitigación de las lesiones tisulares normales por radiación. Se realizó un cribado in vitro de una amplia gama de agentes antimicrobianos para determinar si alguna de estas moléculas podría utilizarse como mitigador de la lesión por radiación. En una prueba que utilizó células progenitoras hematopoyéticas en un ensayo de supervivencia clonogénica, la tetraciclina se identificó como un mitigador significativo (326). En otro cribado in vitro de linfocitos de ratón, se identificaron dos clases de antibióticos, tetraciclinas y fluoroquinolonas (10 moléculas diferentes), como posibles mitigadores de radiación, que los autores atribuyeron a estar separados de sus propiedades antibacterianas. A partir de estos mitigadores potenciales, la tetraciclina mostró eficacia en un modelo de supervivencia de ratón con LCT y la minería de datos adicional confirmó estos hallazgos anteriores (327). El impacto previsto de las quinolonas en la mitigación de las lesiones por radiación no fue sorprendente, dado que estudios anteriores en ratones que mostraron que la ciprofloxacina, la esparfloxacina y la clinafloxacina podrían mejorar las unidades formadoras de colonias en la médula ósea y los recuentos de glóbulos blancos en ratones irradiados (328). Del mismo modo, un estudio publicado de 1961 mostró que la presencia de clortetraciclina en la alimentación de roedores disminuyó la eliminación de rayos X en ratones (329). En estudios más recientes, se encontró que las fluoroquinolonas, como la ciprofloxacina y la levofloxacina, así como la doxiciclina y la neomicina, aumentan el tiempo medio de supervivencia en ratones expuestos a dosis letales de radiación. La doxiciclina y la neomicina también mejoraron la supervivencia del día 30 en los animales (330). En otro trabajo, también se demostró que la ciprofloxacina, un antibiótico notable por su eficacia en el tratamiento de la neumonía bacteriana y otras infecciones, mejora la supervivencia después de la exposición a la radiación in vivo e in vitro. En estudios que utilizaron células mononucleares de sangre periférica, la ciprofloxacina protegió contra la exposición a la radiación al inhibir la fosforilación de p53 y aumentar la producción de Bcl-2 (331), y también se ha demostrado que aumenta la supervivencia en un modelo de ratón de LCT (332).
Terapias Celulares
El desarrollo y uso de terapias celulares, tanto en la clínica oncológica (333) como como tratamiento radioterápico (334, 335), ha sido durante mucho tiempo un enfoque de interés. En particular, se ha demostrado que las células madre mesenquimales (o estromales) (MSC) mitigan los efectos de la lesión pulmonar inducida por la radiación (336, 337). Las células madre, así como las vesículas extracelulares también se están considerando como un medio para tratar las lesiones causadas por el SARS-CoV-2 (338). Específicamente, las MSC derivadas de diversas fuentes, están en estudio para abordar las lesiones pulmonares en pacientes con COVID-19 (339). Estas fuentes incluyen la médula ósea (340), el cordón umbilical (341), el tejido adiposo (342), la sangre periférica y la placenta. El trabajo informado temprano indica que el uso de MSC en pacientes es seguro y su uso es efectivo para mejorar los resultados funcionales pulmonares (343). Hay más de 30 ensayos clínicos en todo el mundo en los que estas células se están utilizando como tratamientos contra la COVID-19 (clinicaltrials.gov). De hecho, varias terapias celulares que están bajo investigación activa para su desarrollo como mitigadores de lesiones tisulares normales por radiación también se muestran prometedoras como terapias en ensayos de pacientes con COVID-19. Estos ensayos incluyen los de células expandidas placentarias (PLX)13 y células progenitoras adultas multipotentes (Multi-Stem; Athersys Inc., Cleveland, OH).®®14
CONCLUSIONES
La mayoría de las infecciones por SARS-CoV-2 son asintomáticas o sintomáticamente leves y no requieren hospitalización. Sin embargo, al momento de escribir este artículo, hay más de 50 millones de infecciones confirmadas en todo el mundo, con más de 9 millones de casos confirmados solo en los Estados Unidos, de los cuales cientos de miles han requerido hospitalización y más de 225,000 han muerto.
Si bien los factores del huésped, como las comorbilidades, la edad y posiblemente la genética, están fuertemente asociados con la gravedad de la enfermedad,
está claro que la patología de COVID-19 grave se caracteriza por una respuesta inflamatoria desregulada, la llamada «tormenta de citoquinas», junto con una respuesta trombótica que involucra niveles elevados de dímero D y coagulopatías que van desde trombos de vasos pequeños hasta DIC.
La tormenta de citoquinas se manifiesta a través de altos niveles de citoquinas proinflamatorias como IL-1β, IL-6, IL-18 y TNFα.
Los efectos sistémicos acumulativos de la respuesta hiperinflamatoria y la actividad trombótica desregulada pueden conducir a la insuficiencia multiorgánica y la muerte.
En la ausencia actual de intervenciones profilácticas efectivas, se necesitan urgentemente terapias capaces de alterar beneficiosamente estos procesos desregulados y apoyar la recuperación.
Una característica sorprendente de la desregulación inmune, la progresión de la enfermedad y los mecanismos de daño a los órganos en COVID-19 es su similitud con las respuestas biológicas a la exposición a la radiación ionizante a dosis lo suficientemente grandes como para causar ARS (>2 Gy en humanos).
La similitud de las respuestas inflamatorias y los daños en los órganos causados por COVID-19 y la radiación ofrece una oportunidad para posibles intervenciones de COVID-19. Hay una gran cantidad de datos (detallados anteriormente) y una amplia experiencia en el campo de la biología de la radiación para el desarrollo de mitigadores de radiación que se dirigen a la desregulación inducida por la radiación de la inflamación, la fibrosis pulmonar y el daño vascular que pueden conducir a la insuficiencia multiorgánica y la muerte de una manera similar a la observada en COVID-19. Muchos de estos agentes se encuentran actualmente en niveles preclínicos de desarrollo, pero varios ya están autorizados como mitigadores de radiación y aprobados por la FDA para su uso en humanos (Neupogen, Neulasta, Leukine), o han demostrado seguridad en ensayos clínicos en humanos para otras indicaciones y, por lo tanto, están bien preparados para una posible traducción a indicaciones de COVID-19.
Finalmente, en quizás la definición más verdadera de superposición entre radiación y COVID-19, es la propuesta novedosa (y sin embargo «de la vieja escuela»), de que la radioterapia de dosis baja (LDRT), que implica la exposición del tórax del paciente, puede tener eficacia para contrarrestar las infecciones pulmonares, incluidas las causadas por la infección por SARS-CoV-2. Este concepto se basa en estudios sobre el uso de exposiciones a la radiación a principios de 1900, antes del advenimiento de los antibióticos modernos, en los que la radiación se usaba para tratar neumonías resultantes de infecciones bacterianas o virales (344). Esta propuesta de tratamiento, sin embargo, no está exenta de controversia. Ya se han publicado numerosos editoriales y comentarios (345-352) y la discusión en torno a esta modalidad de tratamiento sin duda continuará. No obstante, la LDRT no se considera un mitigador potencial del daño pulmonar por radiación en dosis altas y, por lo tanto, este tratamiento generalmente queda fuera del alcance de la revisión actual.®®®
Si bien la experiencia médica en los campos de enfermedades infecciosas, neumología, inmunología, reumatología y hematología son caminos críticos hacia adelante en la búsqueda de intervenciones terapéuticas COVID-19, la superposición sustancial en patobiología entre COVID-19 y ARS presenta la posibilidad de intervenciones farmacológicas fácilmente traducibles y potencialmente de alto impacto que se evaluaron y / o desarrollaron originalmente para mitigar la lesión por radiación en humanos.
De la misma manera, es posible que, dada la amplia gama de nuevos enfoques de tratamiento que se están considerando para una posible eficacia en las infecciones por COVID-19, algunos de estos podrían algún día ser reutilizados para su uso como contramedidas médicas de radiación.
AUTORES: Carmen I. Rios, David R. Cassatt, Brynn A. Hollingsworth, Merriline M. Satyamitra, Yeabsera S. Tadesse, Lanyn P. Taliaferro, Thomas A. Winters, Andrea L. DiCarlo. PUBLICACIÓN: 16 octubre de 2020. ORIGINAL: BioOne Complete.