Resumen
La resistencia bacteriana presenta dilemas terapéuticos a los médicos de todo el mundo. Las advertencias estaban ahí hace mucho tiempo, pero muy pocas personas las escucharon. Así, un problema emergente se ha convertido en una crisis. La resistencia es un fenómeno ecológico derivado de la respuesta de las bacterias al uso generalizado de antibióticos y su presencia en el medio ambiente.
Al determinar las consecuencias de la inacción en la salud pública presente y futura, debemos trabajar para remediar la falta de acción en el pasado. Al mejorar el uso de antibióticos y disminuir la frecuencia del gen de resistencia a nivel local, podemos avanzar hacia la reversión del problema de resistencia a nivel mundial.
* * * * * *
A medida que entramos en el nuevo siglo,
por fin vemos un acuerdo, de varias organizaciones y formuladores de políticas, de que el uso indebido de antibióticos es una causa importante de resistencia a los medicamentos bacterianos,
aunque todavía falta la relación cuantitativa directa entre la cantidad de antibiótico utilizado y la frecuencia de resistencia . Este punto puede parecer simplista, pero desde los primeros signos de resistencia, hubo renuencia entre los proveedores y fabricantes para vincular el problema con el uso indebido de antibióticos.
Algunos consideraron la resistencia clínica como una consecuencia inevitable del uso. Estoy en desacuerdo. La resistencia se convierte en un problema cuando se presenta en una infección bacteriana resistente, no en una bacteria aislada.
El problema clínico surge cuando se diezman las cepas susceptibles, lo que permite que la flora microbiana resistente prospere y, en algunos entornos, gane prominencia.
Estas alteraciones de la flora, consecuencia del mal uso y el uso excesivo de estas valiosas terapias, son la fuente de cepas de enfermedades clínicas resistentes. La resistencia bacteriana, que comenzó como un problema emergente, se ha convertido en una crisis [1].
DOS COMPONENTES NECESARIOS DE LA RESISTENCIA: EL ANTIBIÓTICO Y EL GEN DE RESISTENCIA
Al estudiar el problema de la resistencia, debemos centrarnos en dos componentes del fenómeno de resistencia a los medicamentos: el agente antibiótico y el gen de resistencia. Ambos son necesarios para producir un problema de resistencia clínica [ 2 ].
En 1998, se produjeron unos 50 millones de libras de antibióticos en los Estados Unidos, de los cuales
aproximadamente la mitad se destinó a personas en hospitales y hogares.
De la otra mitad,
aproximadamente el 80% se dio a los animales para diversas indicaciones.
El 20% restante
se aplicó a otros organismos: abejas, plantas, árboles, etc.
A principios de la década de 1990,
determiné que 50,000 libras de antibióticos se usaban en la agricultura anualmente bajo la designación de «pesticidas» [3]
En los Estados Unidos,
los pesticidas incluyen antibióticos, como la tetraciclina y la estreptomicina.
La Agencia de Protección Ambiental (EPA, por sus siglas en inglés) informó recientemente de que
se rocían 300,000 libras de antibióticos en los árboles frutales anualmente en las partes del sur de los Estados Unidos [4].
Esta práctica también es común en muchas partes de América Central y del Sur.
Uno puede imaginar la propagación geográfica de los antibióticos por medio de esta aplicación,
complicada aún más por la dilución de las drogas a medida que la lluvia y otros movimientos naturales los dispersan en el medio ambiente.
El resultado final son
excelentes condiciones para la selección de resistencia a los medicamentos.
DOSIS TERAPÉUTICA DE ANTIBIÓTICOS Y DENSIDAD DE SELECCIÓN
Aunque el agente antibiótico es un factor importante que afecta la resistencia a los antibióticos, su función selectiva se relaciona no solo con la cantidad total, sino también con la forma en que se usa.
El mismo antibiótico proporcionado de diferentes maneras puede tener efectos significativamente diferentes sobre la resistencia a los antibióticos. Un estudio encontró que, cuando la penicilina se administraba en dosis menos que terapéuticas y durante períodos de tiempo relativamente largos (5 días), el riesgo de los pacientes de portar neumococos resistentes a la penicilina aumentó [5]. Cuando el medicamento se usó en la dosis correcta por períodos cortos de tiempo, la aparición de Streptococcus pneumoniae resistente a la penicilina fue considerablemente menor [5].
Podemos extrapolar estos hallazgos del neumococo a muchos otros organismos bajo presión de selección debido al uso de agentes antibióticos.
Es el uso prolongado de bajo nivel el que selecciona óptimamente la resistencia bacteriana. Si podemos cambiar esta práctica, podremos tener un gran impacto sobre la resistencia.
Además, la forma en que se distribuye una cantidad de un agente antibiótico entre los individuos dentro de un área geográfica particular influye en la frecuencia de las bacterias resistentes a los antibióticos. Dar 1000 dosis del antibiótico a 1 individuo tendrá un efecto ecológico considerablemente menor en la aparición de resistencia que dar esas mismas 1000 dosis a 1000 individuos. Este concepto es lo que yo llamo densidad de selección (figura 1) [6].
Debemos centrarnos no solo en la cantidad de antibiótico, sino también en cuántas personas reciben ese medicamento y qué tan limitada es el área bajo tratamiento.
Es una cuestión de ecología: el efecto neto del antibiótico sobre el número de bacterias resistentes y, lo que es más importante, sobre los organismos susceptibles sobrevivientes residuales que quedan en el medio ambiente.
Cuanto mayor sea el número de microorganismos susceptibles, más rápido será el retorno a una microflora susceptible.
Figura 1

FIG. 1. Una definición de densidad de selección. La selección de bacterias resistentes a los antibióticos involucra el número de individuos afectados (porque sirven como «fábricas» de bacterias resistentes) y la densidad de estos individuos en un ambiente particular. A medida que aumenta la densidad de los miembros tratados, aumenta el número de cepas resistentes y disminuye el número de cepas susceptibles capaces de sobrevivir en el medio ambiente.
VIDA DEL ANTIBIÓTICO DESPUÉS DEL TRATAMIENTO
La otra característica desconocida y no estudiada del antibiótico es su «vida después del tratamiento» (figura 2).
Puede ser que la resistencia surja más fácilmente en entornos donde el fármaco se deposita, después de su aplicación, que en el paciente, planta o animal que se está tratando.
Los antibióticos son muy estables. Recientemente se han detectado en aguas municipales [7].
En mi propio laboratorio,
almacenamos tetraciclina durante varios meses en suelos naturales. Cuando extrajimos el suelo, la tetraciclina todavía estaba presente en su concentración original (datos no publicados).
Hay un número relativamente pequeño de mecanismos de resistencia que realmente atacan al fármaco (tabla 1). Las β-lactamasas destruyen las penicilinas y las cefalosporinas, la acetilación ataca al cloranfenicol, las enzimas inactivan los macrólidos y otros agentes inactivan los aminoglucósidos. Pero la mayoría de los casos de aparición de resistencia a los antibióticos están vinculados a un cambio en el objetivo del medicamento o a un cambio en su transporte [8]. Los últimos mecanismos dejan el antibiótico intacto para continuar el proceso de selección. Esta es una característica de la resistencia a los antibióticos que no se ha estudiado ni cuantificado con respecto a la aparición de resistencia.
Sugiero que los residuos de antibióticos ambientales pueden ser la fuerza principal en la selección y propagación de cepas resistentes (figura 2).
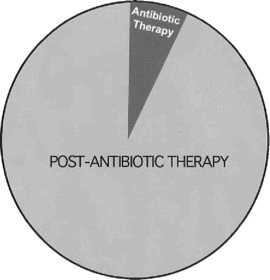
FIG. 2. Diagrama que muestra que los antibióticos permanecen más tiempo en el ambiente después de los tratamientos que durante los mismos. Los antibióticos afectan a la comunidad microbiana siempre que permanezcan intactos y en niveles inhibidores del crecimiento. La duración de la terapia es considerablemente más corta que la vida útil de los antibióticos en el ambiente después de la terapia. Como compuestos activos, continúan siendo selectores de resistencia a los medicamentos.
Tabla 1
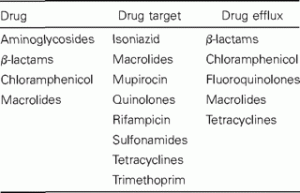
Tabla 1. Sitio de acción del mecanismo de resistencia, según la clase de antibiótico afectado.
El segundo componente que impacta el fenómeno de resistencia es el gen mismo.
Los genes de resistencia, transportados por elementos transportables, como plásmidos y transposones, pueden propagarse fácilmente en el medio ambiente.
Hace algún tiempo, los trabajadores mostraron que la transferencia de un plásmido H2 sensible a la temperatura, transferible y resistente a múltiples fármacos entre Escherichia coli en vacas se produjo en el medio ambiente, no en los animales, cuya temperatura corporal no permitió la transferencia [9].
Fuera del animal, la temperatura ambiente más baja permitió la transferencia de los plásmidos a nuevos receptores de E. coli.
Estos E. coli posteriormente
fueron ingeridos por las vacas, que luego fueron colonizadas por las cepas recientemente resistentes.
Dicha adquisición de nuevas cepas receptoras no se produjo en vacas amordazadas que no pudieron ingerirlas del medio ambiente.
Esta fue una demostración convincente de que los eventos de transferencia ocurren en el entorno.
La resistencia se origina como un fenómeno local, pero puede expandirse a proporciones globales.
Cualquier problema localizado puede ser transportado, porque los viajes internacionales traen aislamientos de un país a otro.
En la década de 1960, J. Olarte [10]
demostró la propagación de bacterias resistentes entre los países,
quien reexaminó algunos de los patógenos entéricos en su colección almacenada. Encontró cepas de Shigella dysenteriae que tenían resistencia al cloranfenicol, estreptomicina y tetraciclina, conferidas en cada caso por el mismo plásmido, que habían sido aisladas en muchas ciudades diferentes de América del Sur (Figura 3) [10].
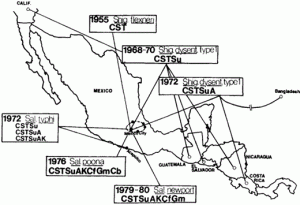
Fig. 3. La propagación de múltiples cepas de Shigella y Salmonella resistentes a antibióticos en América Central. Gran parte de estos datos se reunieron en retrospectiva, después de que los organismos en los diferentes países habían sido identificados [10]
Los genes se transfieren entre bacterias de tipos muy diferentes.
En una nota histórica, es interesante reflexionar sobre los comentarios de Sir Richard Sykes y Sir Mark Richmond hace más de 30 años:
“En términos prácticos, la transferencia de genes intergenéricos del tipo descrito aquí puede significar que muchos genes, particularmente aquellos que confieren resistencia a los antibióticos, que generalmente se encuentran entre las Enterobacteriaceae, también pueden ocurrir entre las cepas de Pseudomonas aeruginosa , y viceversa ”[ 11]
Nuestro conocimiento se ha desarrollado significativamente desde estas primeras observaciones. De hecho,
la transferencia de genes puede ocurrir entre bacterias grampositivas y gramnegativas, de modo que un determinante de resistencia que ocurre en cualquier organismo puede eventualmente llegar a cualquier otro organismo.
Aunque un determinante de resistencia puede transferirse directamente, es más probable que siga una ruta tortuosa, pasando por múltiples donantes y receptores antes de establecerse en un nuevo género de bacterias [12].
LOS ALIMENTOS CRUDOS CONTIENEN BACTERIAS RESISTENTES O RESTOS DE ANTIBIÓTICOS
Otra consecuencia de nuestra inacción contra el uso descontrolado de antibióticos se manifiesta por bacterias resistentes a múltiples fármacos excretadas en las heces humanas y animales.
En un estudio que realizamos en las décadas de 1970 y 1980, encontramos resistencia a 2, 3 y 4 antibióticos diferentes entre la flora fecal comensal de voluntarios humanos que no ingieren antibióticos.
En aquellos sujetos que consumieron un antibiótico, la resistencia a múltiples medicamentos (50% de la flora coliforme) fue significativamente mayor [13]. Otros investigadores han informado hallazgos similares [14 , 15].
El nuevo sitio web sobre Reservorios de resistencia a antibióticos (ROAR) mantenido por la Alianza para el uso prudente de antibióticos ( http://www.who.int/emc/WHONET/WHONET.html) muestra que
el ambiente está lleno de genes ROAR en bacterias que pueden no causar enfermedad, pero que pueden ser donantes de resistencia a bacterias potencialmente patógenas.
¿Dónde surgió la resistencia en la flora fecal?
Los datos sugieren que proviene de los alimentos crudos que comemos.
En un estudio anterior,
se descubrió que los vegetarianos portaban algo más , no menos, flora fecal resistente que los carnívoros [16].
Aunque la carne puede estar contaminada con bacterias resistentes a los antibióticos, los consumidores de carne generalmente cocinan la carne antes de comerla. Los vegetarianos comen alimentos crudos.
Encontramos muchos organismos fermentadores de lactosa con resistencia a múltiples fármacos en zanahorias, apio, lechuga, pepinos, pimientos y tomates [17].
Denis Corpet examinó a 6 voluntarios que consumían una dieta normal que luego fueron cambiados a alimentos esterilizados. Hubo una disminución de 1000 veces en las bacterias resistentes a la tetraciclina con la dieta esterilizada [18].
Este estudio tiene al menos 2 implicaciones:
los alimentos tienen bacterias resistentes o albergan residuos de antibióticos.
Sin embargo, el hallazgo nos da una razón para el optimismo.
Nuestro transporte de flora fecal resistente no es algo que estamos destinados a perpetuar. Necesitamos limpiar nuestro suministro de alimentos.
El impacto real de esta resistencia ubicua se manifiesta en el entorno hospitalario, donde los principales tipos y números de patógenos resistentes han aumentado en la última década. Más recientemente, junto con Staphylococcus aureus resistente a meticilina (MRSA), han aparecido MRSA con resistencia heterogénea a la vancomicina. Estos pueden convertirse en cepas que ahora llamamos S. aureus resistente a la vancomicina (VRSA) [19]. Tenemos enterococos resistentes a la vancomicina (ERV). Entre las bacterias gramnegativas, hay Klebsiella, especies de Enterobacter con β-lactamasas de espectro extendido , P. aeruginosa , y el miembro más nuevo, Acinetobacter baumannii ( tabla 2 ).

Tabla 2. Microorganismos con resistencia a los medicamentos que son muy problemáticos en los hospitales.
¿La resistencia heterogénea a la vancomicina tiene importancia clínica? En un grupo de 19 pacientes ortopédicos infectados con MRSA, el tratamiento con vancomicina falló en 13 [ 20 ]. Estas no eran personas sometidas a quimioterapia o que estaban inmunocomprometidas. Cuando los médicos revisaron a los pacientes, encontraron que la mayoría de los pacientes para quienes el tratamiento falló (12 de 13) estaban infectados con MRSA que tenía resistencia heterogénea a la vancomicina [ 20 ]. Esta es una diferencia muy significativa e ilustra cómo incluso una pequeña proporción de la población bacteriana con resistencia puede afectar el resultado clínico. Un artículo reciente informó que la terapia con quinolona falló para las personas infectadas con Salmonella typhimurium DT104 que tenían resistencia a quinolonas de bajo nivel [21 ]. Aunque no está en el rango de resistencia clínica, la susceptibilidad reducida de las cepas a las fluoroquinolonas parece tener un impacto en el resultado del tratamiento.
Cuando Janice Bates en Oxford encontró el determinante VanA en enterococos que se aislaron de animales de granja [ 22 ], pasó un tiempo antes de que el hallazgo se vinculara con el uso de otro glucopéptido, a saber, la avoparcina, como promotor del crecimiento. Todavía existe controversia sobre si estas cepas de animales son el reservorio de las cepas que infectan a las personas. Cabe destacar que el determinante de resistencia a la vancomicina (VanA) no se quedó en E. faecium y E. faecalis , donde se identificó por primera vez, sino que se transfirió a otras especies y otros géneros ( tabla 3 ). El determinante de VanB se trasladó a Streptococcus bovis [ 23 ]. Transferencia de VanA de Enterococcus aS. aureus se ha observado tanto en filtros como en piel de ratón [ 24 ].
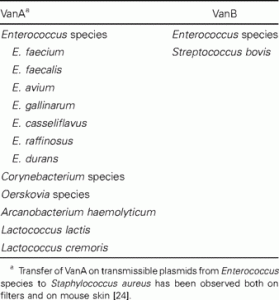
Tabla 3. Microorganismos con resistencia a la vancomicina, por determinante de resistencia.
Nuestro continuo fracaso para contener la propagación de genes de resistencia ahora ha comprometido el tratamiento de salud en la comunidad.
Ahora tenemos 6 organismos principales que son problemáticos debido a la resistencia a múltiples fármacos (tabla 4). Incluso han surgido cepas de Streptococcus pyogenes, una especie que históricamente ha sido susceptible a los medicamentos, que tienen resistencia a los macrólidos y a la tetraciclina. A esta lista de organismos, podemos agregar las cepas de S. typhi con resistencia a múltiples fármacos que han causado epidemias en los países en desarrollo [25].

Tabla 4. Microorganismos con resistencia a los medicamentos que son problemas importantes en la comunidad.
La resistencia tiene consecuencias ecológicas, algunas de las cuales no se pueden predecir. Cuando se introdujeron las cefalosporinas de segunda y tercera generación a principios de la década de 1980 para el tratamiento de infecciones gramnegativas, el enterococo surgió como un nuevo patógeno oportunista, debido a la resistencia intrínseca a los β-lactámicos. Cuando comenzamos a usar vancomicina para MRSA, la primera resistencia a la vancomicina no apareció entre los estafilococos, sino entre los enterococos, que habían sido seleccionados previamente por las cefalosporinas. Solo ahora estamos viendo resistencia a la vancomicina en el estafilococo [19]. El imipenem utilizado para Klebsiella, P. aeruginosa, Xanthomonas y Enterobacter provocó problemas con Acinetobacter. No podemos predecir necesariamente el resultado de la resistencia. Puede o no ocurrir en el organismo contra el cual estamos dirigiendo el tratamiento.
Tratar de obtener información sobre el costo de la resistencia es difícil porque hay pocos datos reportados. Un estudio estimó costos entre $ 150 millones y $ 30 mil millones anuales, dependiendo de cuántas muertes fueron causadas por la resistencia [26]. Al revisar una serie de estudios con bacterias susceptibles y resistentes, otro grupo concluyó que la resistencia conduce a duplicar las tasas de morbilidad y mortalidad y hospitalización [27]. Un estudio más reciente del grupo Lewin mostró que MRSA, que puede representar el 60% de S. aureus adquirido en hospitales, provocó 630 muertes en la ciudad de Nueva York y costos muy altos para un solo organismo [28]. Podemos decir claramente que la resistencia es costosa. Pero, necesitamos datos sobre costos para convencer a las autoridades gubernamentales de que pongan más fondos para enfrentar este problema.
Ha habido acción, pero lamentablemente muy poca. Uno de los primeros ejemplos que trajo comprensión y cambio en relación con los antibióticos y el problema de la resistencia a los antibióticos en los hospitales provino de Henry Isenberg [29]. Estimó que
se rociaban entre 15 y 30 litros de antibióticos altamente concentrados en un entorno hospitalario de 300 camas al año como consecuencia de limpiar la última burbuja de aire de la jeringa [29].
Sus hallazgos fueron fundamentales para poner fin a esta práctica. Ahora tenemos nuevos tipos de jeringas, que no requieren tales maniobras de preinyección. Necesitamos muchas otras acciones similares, tanto a pequeña como a gran escala.
LA ACCIÓN INAPROPIADA ES AÚN PEOR QUE LA INACCIÓN: 300 ANTIBACTERIANOS EN EL HOGAR
La inacción es una cosa. La acción inapropiada empeora las cosas.
La venta de productos para el hogar con agentes antibacterianos se ha disparado. En la actualidad, hay más de 300 productos que contienen agentes antibacterianos en el mercado minorista sin receta, desde desinfectantes hasta colchones, en comparación con menos de 40 de estos productos hace 6 años.
En el barrio chino de Boston, puedes comprar palillos que contienen antibacterianos.
El triclosán, un químico utilizado en productos hospitalarios, ahora se introduce en los hogares a través de cientos de artículos para el hogar.
Hemos demostrado que el triclosán tiene un objetivo, la enzima enoil reductasa, que participa en la biosíntesis de ácidos grasos [30]. Además, un locus genético en E. coli proporciona resistencia al triclosán y a múltiples antibióticos a través de una bomba de eflujo de múltiples fármacos [31].] Por lo tanto,
existe un vínculo entre la resistencia a los antibacterianos y la resistencia a los antibióticos.
La selección de resistencia por un grupo de agentes puede seleccionar resistencia a otros.
Durante 1997–1999, hubo 4 muertes por infección MRSA adquirida en la comunidad entre 200 individuos portadores de MRSA en Minnesota y Dakota del Norte [32]. Se han aislado cepas en Toronto y en otras partes de los Estados Unidos y en Europa. Estos MRSA no se originaron dentro del hospital. Son únicos en la resistencia a la carga solo a los antibióticos β-lactámicos. Hay muchas preguntas sin respuesta asociadas a este desarrollo
¿Por qué nos enfrentamos a MRSA en la comunidad? ¿Cuál es el factor selectivo? ¿Es el uso de antibióticos? ¿O estamos convirtiendo nuestros hogares en hospitales porque los productos químicos antibacterianos de estilo hospitalario ahora se están utilizando en el hogar?
Actualmente no tenemos datos útiles para responder estas preguntas importantes.
En gran medida, la inacción caracteriza nuestro pasado, pero no debe describir el presente o el futuro.
Necesitamos actuar sobre el conocimiento que ya hemos adquirido con respecto a la resistencia a los antibióticos.
Una organización internacional, la Alianza para el Uso Prudente de Antibióticos (http://www.apua.org), establecida en 1981, se dedica a hacer un cambio a través de la educación y la comunicación. Fue difícil movilizar acciones porque pocos aceptaron que el problema existía.
Afortunadamente,
la conciencia ha aumentado recientemente, pero el cambio de comportamiento es difícil de lograr.
Espero que salgan medidas correctivas de esta reunión, proporcionando formas y direcciones para reducir y revertir el problema de resistencia que enfrentamos hoy.
AUTOR: Prof. Stuart B. Levy (1938-2019). Centro de Genética de Adaptación y Resistencia a Drogas, Facultad de Medicina de la Universidad de Tufts, Boston. ORIGINAL Y REFERENCIAS: Oxford Academy. Clinical Infectious Disease. PDF. TRADUCCIÓN: jna.









