Abstracto
La posibilidad de que la enfermedad de Alzheimer (EA) tenga una etiología microbiana ha sido propuesta por varios investigadores. Aquí, proporcionamos evidencia de que el tejido del sistema nervioso central (SNC) de los pacientes con EA contiene células fúngicas e hifas. El material fúngico se puede detectar tanto intra como extracelularmente utilizando anticuerpos específicos contra varios hongos. Diferentes regiones del cerebro, incluida la corteza frontal externa, el hemisferio cerebeloso, la corteza entorrinal/hipocampo y el plexo coroideo, contienen material fúngico, que está ausente en el tejido cerebral de los individuos de control. El análisis de secciones cerebrales de otros diez pacientes con EA revela que todos están infectados con hongos. También se observa infección fúngica en los vasos sanguíneos, lo que puede explicar la patología vascular frecuentemente detectada en pacientes con EA. La secuenciación del ADN fúngico extraído de muestras congeladas del SNC identifica varias especies de hongos. En conjunto, nuestros hallazgos proporcionan evidencia convincente de la existencia de infección fúngica en el SNC de pacientes con EA, pero no en individuos de control.
Introducción
Las enfermedades neurodegenerativas constituyen un grupo heterogéneo de trastornos del sistema nervioso central (SNC) que se caracterizan por una pérdida lenta e irreversible de las funciones neuronales. La etiología de las enfermedades neurodegenerativas primarias, como la enfermedad de Alzheimer (EA), la esclerosis múltiple (EM), la enfermedad de Parkinson (EP) y la esclerosis lateral amiotrófica (ELA), sigue siendo en gran medida desconocida. Una característica común de muchas enfermedades neurodegenerativas es la presencia de agregados de proteínas mal plegadas (inclusiones intracelulares) en regiones del SNC que pueden servir como características neuropatológicas para el diagnóstico de enfermedades [1,2]. Dependiendo de la enfermedad en particular, estos agregados fibrilares insolubles pueden variar en distribución y composición [3]. Desde el punto de vista histopatológico, la EA se caracteriza por la acumulación de ovillos intracelulares de proteína tau hiperfosforilada y depósitos extracelulares de proteína amiloide [4,5]. El procesamiento proteolítico de la proteína precursora amiloide asociada a la membrana (APP) da lugar a la generación del péptido neurotóxico del β amiloide (Aβ) [6,7], que es el componente principal de las placas seniles distintivas en la EA. La citotoxicidad inducida por el péptido Aβ implica la alteración de la homeostasis del calcio, el estrés oxidativo, la disfunción sináptica y la pérdida neuronal [8,9,10]. El dogma predominante para explicar la patogénesis de la EA es que la acumulación de depósitos de amiloide formados por el péptido Aβ puede inducir ovillos intracelulares de proteína tau que a su vez conducen a la muerte neuronal11. Sin embargo, la llamada «hipótesis amiloide» ha sido cuestionada por varios hallazgos, incluido el fracaso de los ensayos clínicos destinados a reducir los depósitos de amiloide o los ovillos de tau [12,13,14]. Además, muchas personas mayores con una función cognitiva normal tienen una carga amiloide sustancial en el SNC11. En la actualidad, no existe una terapia para detener o revertir los síntomas de la EA. Aparte del deterioro cognitivo, la gran mayoría de los pacientes con EA presentan signos claros de inflamación y daño a los vasos sanguíneos [15,16]. La inflamación del SNC y la activación inmunitaria desempeñan un papel importante en la fisiopatología de la EA. De hecho, varias citoquinas, como las interleucinas (IL-1 e IL-6), el factor de necrosis tumoral α y el γ de interferón, están elevadas en el cerebro de los pacientes con EA, lo que sugiere un aumento de la respuesta inmunitaria [17,18,19]. Estas observaciones han llevado a la especulación de que la EA tiene una etiología autoinmune20. Muchos investigadores también han considerado la idea de que la EA es una enfermedad infecciosa, o al menos que los agentes infecciosos constituyen un factor de riesgo para la EA [21,22,23]. En consecuencia, se ha informado de material genético de varios virus y bacterias en cerebros de pacientes con EA. En particular, el herpes simple tipo 1 (VHS-1) y Chlamydophila pneumoniae han sido sugeridos como posibles agentes etiológicos de la EA. Además, la infección cerebral por varios patógenos puede inducir la formación de amiloide [24,25,26]. Además, el péptido Αβ exhibe actividad antimicrobiana y muestra una actividad inhibidora particularmente fuerte contra Candida albicans [27].
Recientemente, proporcionamos pruebas sólidas de la infección fúngica en pacientes con EA [28,29]. Se encontraron ADN fúngico y proteínas en el tejido cerebral congelado de pacientes con EA, pero no en el tejido de control del paciente. Además, el material fúngico podría detectarse intra y extracelularmente en neuronas de pacientes con EA. En el presente trabajo, hemos examinado en detalle la presencia de estructuras fúngicas en diferentes regiones del cerebro de un paciente con EA mediante inmunohistoquímica. No se observó material fúngico en el tejido cerebral de diez individuos de control, mientras que la infección fúngica estaba claramente presente en los cerebros de otros diez pacientes con EA. Además, pudimos amplificar el ADN fúngico del tejido congelado de diferentes regiones cerebrales de la EA. En conjunto, nuestros hallazgos proporcionan evidencia convincente de la presencia de infección fúngica en los cerebros de todos los pacientes con EA analizados.
Resultados
Estructuras fúngicas en el SNC de la EA.
Uno de los enfoques más directos para detectar la infección fúngica en el SNC es la visualización de hongos en secciones de tejido. Está bien establecido que el patrón jerárquico de la degeneración neurofibrilar y, por lo tanto, las lecciones patológicas tempranas en los pacientes con EA generalmente comienzan por modificaciones en la corteza entorrinal, seguida por el hipocampo, la corteza de asociación y finalmente el neocórtex primario [11]. En primer lugar, analizamos secciones fijas de diferentes regiones del SNC de un paciente con EA (AD1) y un individuo control (C1) (Tabla suplementaria I). Las regiones examinadas fueron la corteza frontal externa (EFC), el hemisferio cerebeloso (CEH), la corteza entorrinal/hipocampo (ERH) y el plexo coroideo (CP). En particular, se detectaron células fúngicas en las cuatro regiones examinadas del paciente AD1, como se demostró mediante inmunohistoquímica y microscopía confocal utilizando anticuerpos anti-C. glabrata (Fig. 1). En algunos casos, las células fúngicas eran claramente visibles dentro de las neuronas y exhibían una localización intranuclear como lo indica la contratinción con la tinción de ADN, 4’6-diamidino-2-fenilindol (DAPI). El tamaño de los cuerpos fúngicos fue variable; En algunos casos, el tamaño era de 1 a 2 μm, mientras que el diámetro de otros cuerpos fúngicos era mayor (aproximadamente 5 a 10 μm). En otros casos, se evidenciaron cuerpos fúngicos más pequeños de 0,4 a 1 μm dependiendo del campo analizado. Los cuerpos de 0,4-1 y 1-2 μm son similares a los reportados previamente para algunas células de levadura intracelular [30,31,32]. Estas formas intracelulares se conocen como endomicosomas29,33. Las células endoteliales de la PC también pueden contener cuerpos fúngicos. No se observaron células fúngicas ni material fúngico en las diferentes regiones del SNC del individuo control (C1) (Fig. 1). Curiosamente, la inmunotinción de la proteína tau con anticuerpos específicos localizó tau no solo en el citoplasma, sino también en el núcleo tanto en secciones AD1 como C1. Este hallazgo es consistente con la observación de que los poros nucleares están dañados en las personas mayores, particularmente con enfermedades neurodegenerativas y las proteínas citoplasmáticas pueden reubicarse en el núcleo [34,35]. La tinción de la proteína tau nuclear fue muy fuerte en las neuronas donde se detectaron cuerpos fúngicos intranucleares.
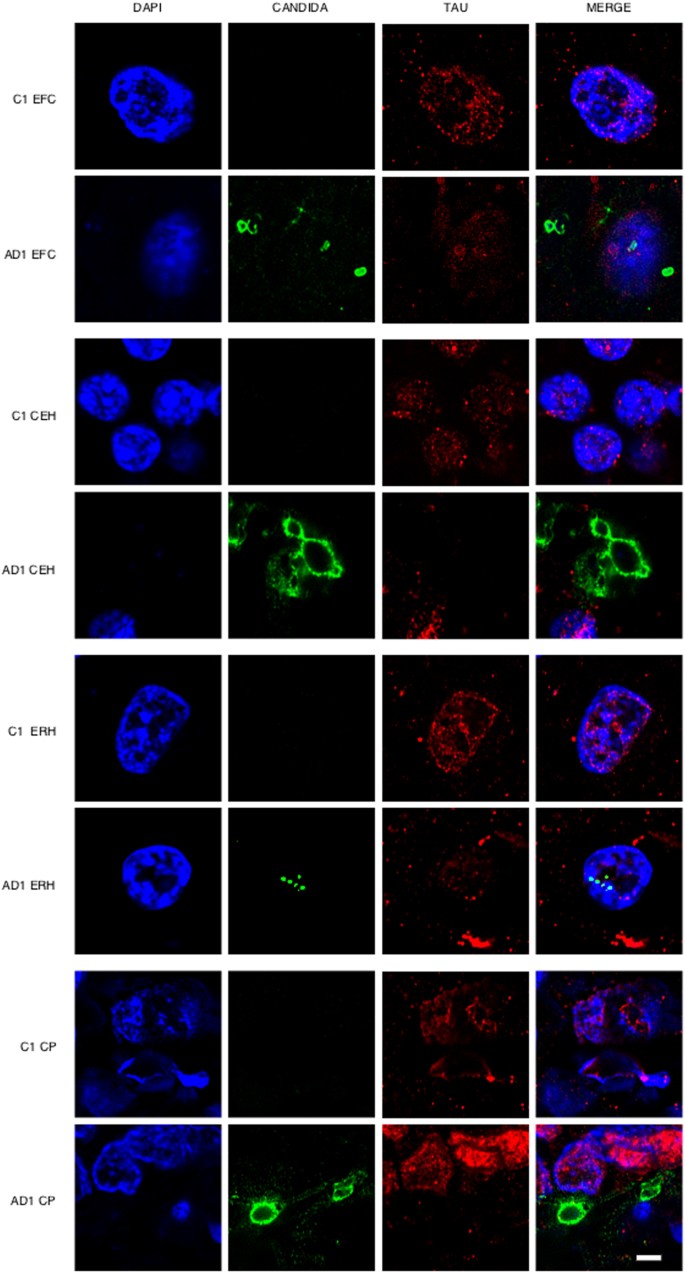
Figura 1.- Análisis inmunohistoquímico de cortes de tejido de diferentes regiones del SNC mediante anticuerpos anti-C. glabrata. A partir de tejido fijado se obtuvieron cortes del SNC del paciente AD1 y del individuo control C1 y se realizó un análisis inmunohistoquímico por microscopía confocal como se detalla en Materiales y Métodos. EFC: corteza frontal externa; CEH: hipocampo cerebeloso; ERH: corteza entorrinal/hipocampo; CP: plexo coroideo. DAPI aparece en azul, anti-C. glabrata se muestra en verde y TauT100 en rojo. Se indican los diferentes paneles de la figura. Barra de escala: 5 μm.
En las Figuras Suplementarias 1, 2 y 3 se muestran campos más amplios que ilustran la presencia de cuerpos fúngicos adicionales y una visión más general de la infección fúngica. Se llevó a cabo la tinción nuclear (DAPI) (azul) y la tinción de inmunofluorescencia doble para detectar estructuras fúngicas (verde) y proteína tau (rojo) y solo se muestra el panel fusionado para restricciones de espacio. Se observaron varias morfologías fúngicas en el EFC, con tamaños que oscilan entre 0,4-1 y 5-10 μm. El tamaño de los cuerpos fúngicos encontrados en la CEH fue de aproximadamente 1-2 μm. Sorprendentemente, dos campos diferentes de la ERH revelaron cuerpos amiláceos (corpus amylacea), que estaban prominentemente teñidos en el borde de estas estructuras redondeadas. Sin embargo, la inmunotinción no se distribuyó uniformemente en todas las zonas fronterizas, lo que indica que el material fúngico no se distribuye de manera homogénea. En conjunto, estas observaciones demuestran la presencia de material fúngico en diferentes regiones del SNC examinadas, pero solo en el paciente con EA (AD1). Las estructuras fúngicas pudieron detectarse fuera y dentro de los núcleos y, en algunos casos, las células fúngicas fueron positivas para DAPI, lo que indica que contienen ácidos nucleicos (véase el panel superior derecho en la Figura 1 suplementaria).
Detección de células fúngicas e hifas mediante diferentes anticuerpos antifúngicos
Hay que tener en cuenta que la inmunorreactividad observada con los anticuerpos anti-C. glabrata no significa necesariamente que esta levadura esté presente. Debido a que los anticuerpos empleados son policlonales de conejo, pueden reaccionar de forma cruzada con una serie de proteínas de otros hongos. El espectro de proteínas reconocido por los diferentes anticuerpos antifúngicos empleados en este trabajo varía y depende de las especies fúngicas presentes en cada caso. Sin embargo, estos anticuerpos antifúngicos no reaccionan de forma cruzada con las proteínas celulares de los individuos de control. Para evaluar aún más si las células fúngicas estaban presentes en el paciente AD1, llevamos a cabo un análisis inmunohistoquímico utilizando anticuerpos policlonales de conejo contra otros hongos. Cuatro anticuerpos adicionales (levantados contra C. famata, C. albicans, P. betae y S. racemosum) detectaron componentes fúngicos (verde) en las secciones de tejido analizadas (Fig. 2), como se demostró mediante doble tinción con un anticuerpo anti-neurofilamento (rojo). Como se indicó anteriormente, el tamaño de las células fúngicas detectadas con los anticuerpos varió. Los anticuerpos adicionales también detectaron estructuras fibrilares largas que se asemejan claramente a hifas fúngicas, con tamaños que oscilan entre 0,1 μm y 1-2 μm. La variedad de tamaños y morfologías observadas en estas secciones utilizando diferentes anticuerpos antifúngicos es consistente con la noción de que varias especies de hongos estaban presentes en las tres regiones del SNC examinadas. Los análisis de secciones de tejido de C1 con estos anticuerpos no revelaron ningún material fúngico (resultados no mostrados). Es poco probable que estos anticuerpos reconozcan proteínas humanas presentes solo en muestras del SNC de pacientes con AD1 y formen estructuras que se asemejen a diferentes morfologías fúngicas. Para probar aún más la presencia de proteínas fúngicas en el paciente AD1, extrajimos proteínas de diferentes regiones del SNC de AD1 y C1 y realizamos Western blot con anticuerpos anti-C. albicans (Figura suplementaria 4). No se detectaron bandas proteicas específicas mediante esta técnica, muy probablemente debido al hecho de que la cantidad de proteínas fúngicas es extremadamente baja. Para identificar inequívocamente las proteínas fúngicas en el tejido cerebral de los pacientes con EA, se requieren metodologías proteómicas como hemos informado anteriormente28. Utilizando este enfoque, hemos detectado varias proteínas fúngicas que están presentes en muestras del SNC de pacientes con EA, pero no en individuos de control.
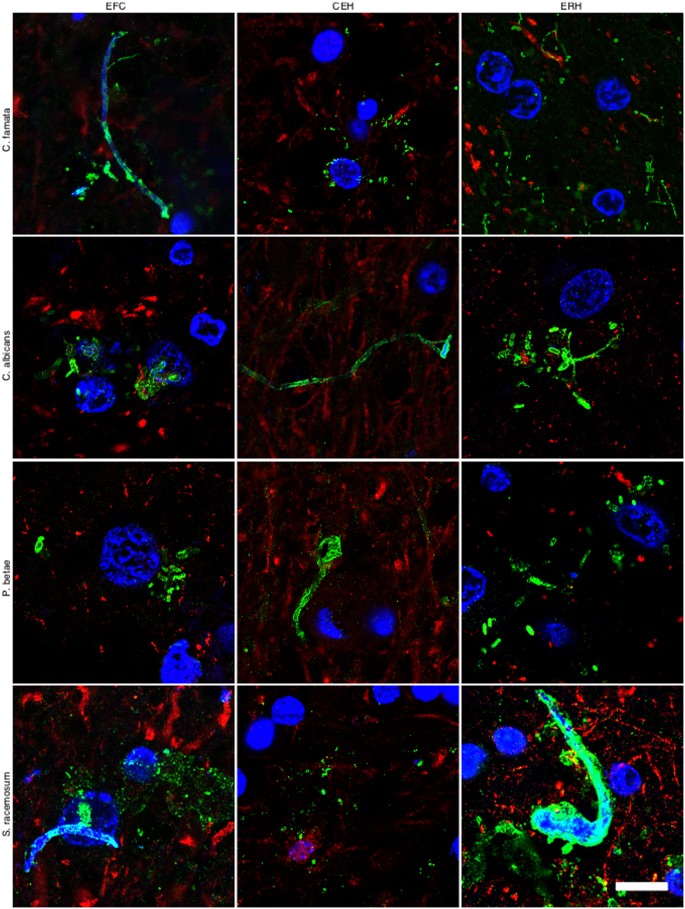
Figura 2.- Análisis inmunohistoquímico de secciones del SNC de pacientes con AD1 utilizando diferentes anticuerpos antifúngicos. Se realizó un análisis inmunohistoquímico de diferentes secciones del SNC del paciente AD1 como se indica en la Fig. 1. EFC: corteza frontal externa; CEH: hipocampo cerebeloso; ERH: corteza entorrinal/hipocampo. DAPI aparece en azul, anti-C. famata, anti-C. albicans, anti-P. betae y anti-S. racemosum se muestran en verde y neurofilamento humano en rojo. Se indican los diferentes paneles de la figura. Barra de escala: 10 μm.
De acuerdo con el hallazgo anterior, algunas células fúngicas e hifas dieron positivo para DAPI (azul), lo que sugiere que contienen ácidos nucleicos (Fig. 2). En las secciones de EFC teñidas con anticuerpos anti-C. famata y anti-S. racemosum, la tinción con DAPI se localizó claramente dentro de las hifas. De hecho, la positividad de DAPI se pudo ver en la gran mayoría de las células e hifas después de tiempos de exposición más largos, pero en estas condiciones los núcleos de las neuronas estaban sobreexpuestos. Para superar esta limitación, la tinción azul DAPI se convirtió en magenta y la tinción de anticuerpos antifúngicos se convirtió en verde. En estas condiciones, se observó una tinción positiva de DAPI en todas las morfologías encontradas, es decir, células en forma de levadura e hifas (Fig. 3) y este fue también el caso cuando se emplearon los anticuerpos anti-C. glabrata (Fig. 1).
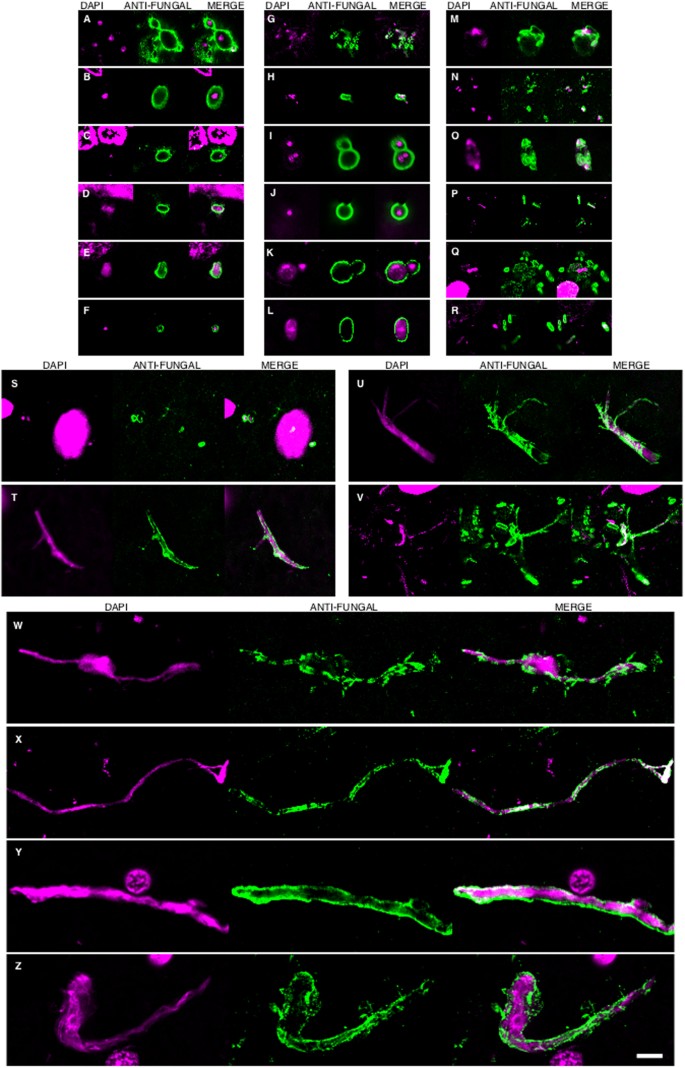
Figura 3.- Tinción DAPI de núcleos de las diferentes morfologías fúngicas. La tinción DAPI se muestra en magenta para visualizar más claramente los núcleos fúngicos. La inmunorreactividad con los anticuerpos fúngicos indicados se muestra en verde. Paneles A-G y S: anti-C. glabrata como anticuerpo primario. Paneles H-J, T, U, W: anti-C. famata como anticuerpo primario. Paneles: K-M, V, X: anti-C. albicans como anticuerpo primario. Paneles N, O, Y, Z: anti-S. racemosum. como anticuerpo primario. Paneles P-R: anti-P. betae como anticuerpo primario. Paneles K, L, S, T, U, Y: EFC del paciente AD1. Paneles A, H, M-Q, X: CEH del paciente AD1. Paneles I, J, R, V, W, Z: ERH del paciente AD1. Paneles B, C, D: PC del paciente AD1. Panel E: ERH del paciente AD3. Panel F: ERH del paciente AD4. Panel G: ERH del paciente AD9. Barra de escala: 5 μm es la misma para todos los paneles que se muestran en la figura.
Debido a que la mayoría de los resultados anteriores se obtuvieron de un solo paciente con EA y un individuo de control, fue de interés examinar secciones del SNC de pacientes y controles con EA adicionales. Para ello, analizamos secciones de tejido de ERH de otros diez pacientes con EA y diez controles mediante doble inmunotinción con anticuerpos antifúngicos (verde) y antitubulina (rojo). En particular, la infección fúngica fue evidente en todos los pacientes con EA estudiados (Fig. 4), mientras que no se detectaron células fúngicas en secciones de tejido de individuos control (Figura suplementaria 5). La morfología de las estructuras fúngicas detectadas en los pacientes con EA adicional fue similar a la descrita para la EA1, aunque no todas las estructuras se encontraron en todos los pacientes. Además, algunas de estas estructuras eran muy llamativas; por ejemplo, se observaron estructuras conidiales en los pacientes AD2 (anti-C. glabrata) y AD8 (anti-C. albicans) y se observó formación de hifas a partir de una célula fúngica en el paciente AD6 (anti-C. albicans). Las pequeñas hifas y células de levadura encontradas en el paciente AD5 (tinción anti-Phoma) fueron muy llamativas. La existencia de diferentes morfologías fúngicas refuerza la idea de que varias especies pueden estar presentes, apoyando el concepto de infecciones fúngicas mixtas. En conclusión, se encontraron células fúngicas y/o hifas en todos los pacientes con EA analizados, aunque las características morfológicas pueden ser diferentes para cada paciente, lo que implica que las especies fúngicas presentes en cada paciente también pueden diferir.
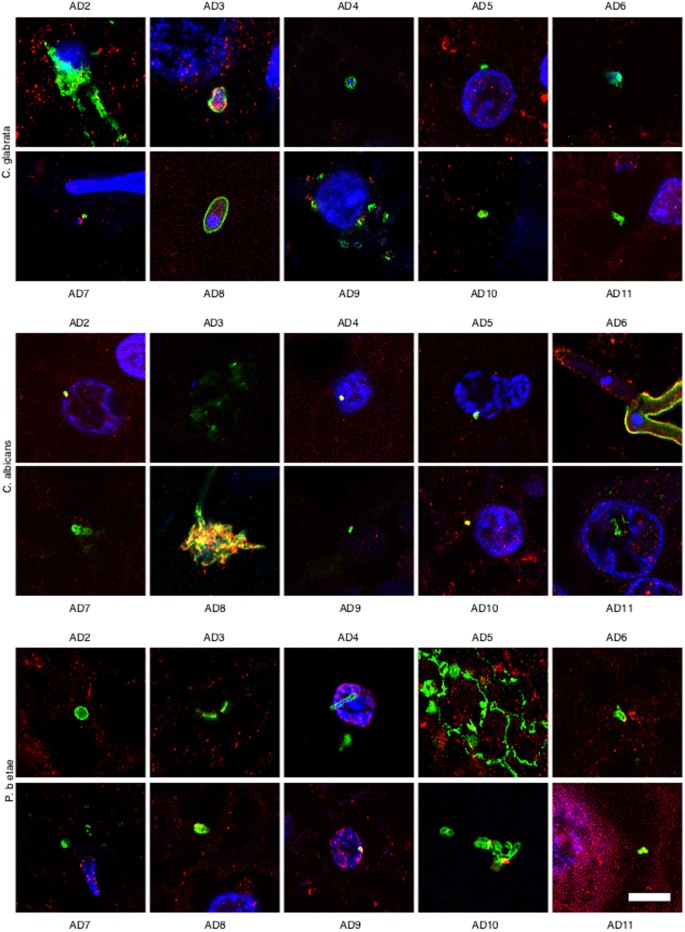
Figura 4.- Análisis inmunohistoquímico de secciones de corteza entorrinal de diez pacientes diferentes con EA. Las secciones de la corteza entorrinal de diez pacientes diferentes con EA se incubaron con diferentes anticuerpos (anti-C. glabrata, anti-C albicans y anti-P. betae) y se muestran en verde; La inmunotinción de α-tubulina humana se muestra en rojo. Se realizó doble ensayo de inmunofluorescencia y microscopía confocal como se indica en la Fig. 1 y Materiales y Métodos. DAPI aparece en azul. Barra de escala: 5 μm.
Infección fúngica del sistema neurovascular
La mayoría de los pacientes con EA presentan lesiones patológicas del sistema vascular en el SNC [16,36]. Hasta el 90% de los pacientes con EA presentan diversas patologías cerebrovasculares, incluyendo angiopatía amiloide cerebral, microinfartos, hemorragias y degeneración microvascular. En consecuencia, los depósitos de β amiloide en las paredes de los capilares, las arteriolas pequeñas y las arterias de tamaño mediano son evidentes en la mayoría de los pacientes con EA estudiados. Estos depósitos de amiloide dan lugar a la angiopatía amiloide cerebral. Razonamos que si la infección fúngica está presente en los vasos sanguíneos, podría inducir la formación de depósitos de amiloide y angiopatía. Para evaluar la infección fúngica en vasos sanguíneos de las regiones EFC, ERH y CP, se realizó un análisis de inmunofluorescencia confocal. Se detectaron células fúngicas de diferentes tamaños e hifas en el interior de los capilares y otros vasos sanguíneos (Fig. 5). También se evidenció cierta tinción en las paredes de los vasos, lo que demuestra que la infección por hongos se puede detectar en el sistema neurovascular. Además, la región CP del paciente AD1 (Fig. 5), pero no de C1 (Figura suplementaria 6), contenía células fúngicas e hifas que inmunorreaccionaron con los diferentes anticuerpos antifúngicos. Estos resultados concuerdan con la idea de que varias especies de hongos pueden infectar los vasos sanguíneos y causar modificaciones patológicas [37,38,39]. Estos estudios se ampliaron al análisis de la región de PC de tres pacientes con EA adicionales (AD12, 13, 14) utilizando varios anticuerpos antifúngicos., De acuerdo con el resultado anterior, se detectó material fúngico en los tres casos examinados, pero no en el control (Figura suplementaria 6). En conclusión, las estructuras fúngicas se pueden observar también en el sistema vascular de los pacientes con EA.
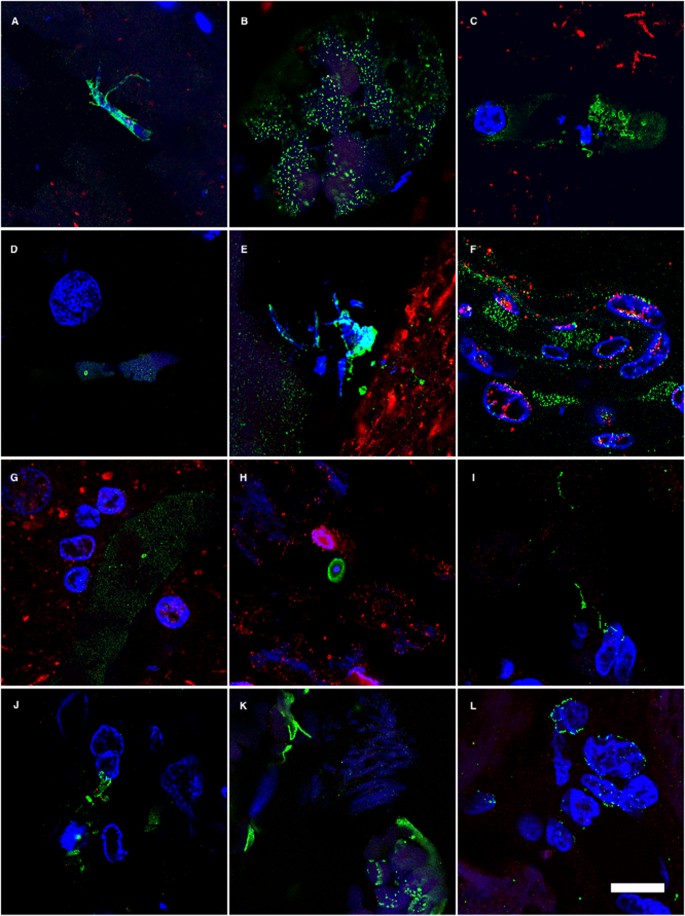
Figura 5.- Cuerpos fúngicos en vasos sanguíneos del SNC del paciente AD1 detectados por inmunohistoquímica. Ensayo de inmunofluorescencia doble analizado por microscopía confocal como se describe en Materiales y Métodos. Se muestran vasos sanguíneos de diferentes regiones del SNC del paciente AD1. Paneles A–E: EFC. Paneles F y G: ERH. Paneles H-L: CP. Paneles A e I: anti-C. famata como anticuerpo primario. Paneles B, C, J: anti-C. albicans como anticuerpo primario. Paneles D, G, K: anti-P. betae como anticuerpo primario. Paneles E y L: anti-S. racemosum como anticuerpo primario. Paneles F y H: anti-C. glabrata como anticuerpo primario. Los anticuerpos antifúngicos se muestran en verde. Se utilizó un anticuerpo anti-neurofilamento humano en todos los paneles, excepto en los paneles F y H, que se tiñeron con anti-TauT100 Anticuerpos (rojo). DAPI aparece en azul. Barra de escala: 10 μm.
Identificación de especies fúngicas en las diferentes regiones del SNC
La amplificación y secuenciación del ADN es el enfoque más preciso para determinar especies fúngicas específicas presentes en los tejidos del SNC. Debido a que la gran mayoría del ADN de las muestras de tejido es humano, previamente desarrollamos un ensayo de PCR anidado sensible para amplificar el ADN fúngico presente en cantidades muy pequeñas [28,33,40,41]. Recientemente utilizamos esta técnica con éxito para identificar varias especies de hongos en muestras de cerebro de pacientes con EA40. Para identificar las especies fúngicas presentes en las diferentes regiones cerebrales del paciente AD1, extrajimos ADN del tejido congelado y realizamos PCR utilizando cebadores que amplifican dos espaciadores internos transcritos (ITS-1 e ITS-2) ubicados entre los genes de ARN ribosómico (ver esquema, Figura suplementaria 7). Se llevaron a cabo varios ensayos de PCR diferentes, ya que, según nuestra experiencia, el uso de varios pares de cebadores asegura la amplificación del ADN de diferentes especies fúngicas. Primero amplificamos ITS-1 con cebadores ITS-1 (externos) y luego se realizaron tres ensayos de PCR diferentes con pares de cebadores internos (ITS-1, internos). Además, el ITS-2 se amplificó primero con cebadores ITS-2 (externos) seguidos de una segunda PCR con un par de cebadores ITS-2 (internos). El ADN amplificado por cada PCR se separó en geles de agarosa y se secuenciaron los fragmentos extraídos. En la Figura complementaria 1 se muestra un resultado típico de la PCR después de la amplificación del ITS-1 utilizando ADN extraído de las diferentes regiones del SNC de los pacientes AD1 y C7. No se amplificaron productos de PCR a partir de ADN extraído de las diferentes regiones de C1, ni de controles para extracción de ADN y PCR. Estos hallazgos revelan que no se produjo contaminación fúngica en el ensayo de PCR ni durante la extracción de ADN. La secuenciación de cada fragmento de los cuatro ensayos de PCR utilizando el ADN del paciente AD1 reveló una serie de especies fúngicas que se enumeran en la Tabla 1. Cabe destacar que se pudieron detectar varias especies de la misma región, lo que apoya el concepto de infección fúngica mixta. Por el contrario, no había una sola especie fúngica presente en las cuatro regiones del SNC examinadas. Cabe destacar que algunas de las especies detectadas, como Malasezzia spp., Phoma y S. cerevisiae, han sido identificadas previamente en cerebros de EA40. Significativamente, la mayoría de las especies enumeradas en la Tabla 1 se describen como patógenos humanos [42,43]. La posibilidad de que diferentes especies fúngicas o una combinación de especies sirvan como factor de riesgo o representen la causa de la EA podría explicar la diversidad observada en la evolución y gravedad de los síntomas clínicos en cada paciente con EA.
Tabla 1.- Especies fúngicas presentes en muestras congeladas del SNC de pacientes con EA detectadas por PCR.
DISCUSIÓN
Uno de los principales objetivos de la investigación de la EA es descubrir la etiología precisa de la enfermedad con el fin de implementar terapias adecuadas para detener o incluso revertir los síntomas clínicos. La posibilidad de que la EA sea una enfermedad fúngica, o que la infección fúngica sea un factor de riesgo para la enfermedad, abre nuevas perspectivas para una terapia eficaz para estos pacientes.
Los presentes hallazgos demuestran que los hongos pueden ser detectados en el tejido cerebral de diferentes regiones del SNC. En los once pacientes (más tres muestras adicionales de PC) descritos en este estudio, así como en cuatro pacientes analizados previamente, existe una clara evidencia de células fúngicas dentro de las neuronas o extracelularmente [29].
Por lo tanto,
el 100% de los pacientes con EA analizados hasta ahora por nuestro laboratorio presentan células fúngicas y material fúngico en cortes cerebrales.
Además, se han encontrado macromoléculas fúngicas (polisacáridos, proteínas y ADN) en el suero sanguíneo de pacientes con EA40 y las proteínas fúngicas y el ADN se detectaron mediante análisis proteómicos y PCR, respectivamente, a partir de tejido congelado del cerebro de la EA28. Las observaciones de otros laboratorios también apoyan la posibilidad de infecciones fúngicas en pacientes con EA. Por ejemplo, se han encontrado cuerpos de quitina en cerebros con EA [44,45]. Se ha sugerido la propuesta de que los polisacáridos similares a la quitina desempeñan un papel en el proceso amiloidogénico y son sintetizados de forma aberrante por las células neurales46; Sin embargo, dado que la quitina es un componente de la pared celular del hongo, parece posible que estos polisacáridos de quitina se originen en hongos. En apoyo de esta idea, se ha encontrado un aumento de los niveles de quitinasa en el suero sanguíneo y el líquido cefalorraquídeo de pacientes con EA [47,48,49,50].
Presumiblemente, la presencia del sustrato, es decir, quitina fúngica, induce la producción de quitinasa. Además, el tratamiento antifúngico en dos pacientes diagnosticados de EA revirtió los síntomas clínicos [51,52]. La interpretación de estos resultados fue que tal vez estos pacientes fueron mal diagnosticados. Curiosamente, el péptido Aβ tiene una potente actividad antimicrobiana, particularmente contra C. albicans [27].
En consecuencia,
podría ser posible que la presencia de una infección fúngica crónica en el SNC de la EA desencadene la síntesis del péptido Aβ, que a su vez conduce a depósitos de amiloide.
Estos informes, junto con nuestros hallazgos actuales, apoyan la noción de que la infección fúngica puede existir en la EA.
Partiendo de la base de que los hongos son el agente etiológico de la EA, todos los síntomas observados en los pacientes con EA pueden explicarse fácilmente.
Por ejemplo, la lenta progresión de la enfermedad encaja bien con la naturaleza crónica de las infecciones fúngicas si no se tratan. Además, la inflamación y la activación del sistema inmunitario pueden deberse a un agente fúngico infeccioso. Las infecciones fúngicas diseminadas pueden inducir la producción de citoquinas [53,54,55], que puede tener lugar años antes del inicio del deterioro cognitivo como se observa en la EA. Por lo tanto, esta infección diseminada puede extenderse lentamente al SNC y la disfunción sináptica y la pérdida neuronal tienen lugar solo cuando la carga fúngica en algunas áreas del SNC es alta.
Es muy posible que la existencia de una infección fúngica facilite la colonización por otras especies fúngicas que pueden afectar a otras zonas del SNC, dando lugar a infecciones fúngicas mixtas.
La diversidad de especies fúngicas que pueden afectar al SNC, así como las combinaciones de estas especies, pueden explicar las diferencias observadas en la evolución y gravedad de los síntomas clínicos encontrados en los pacientes con EA.
La patología de los vasos sanguíneos observada en la mayoría de los pacientes con EA también puede explicarse, ya que pueden estar infectados por hongos [37,38,39], en particular las arterias, donde el contenido de oxígeno es mayor.
Por último, la predisposición genética observada en aproximadamente el 2-5% de los pacientes con EA puede deberse simplemente a su predisposición a adquirir infecciones fúngicas, ya que los antecedentes genéticos de cada individuo son permisivos para ello [56,57].
Hasta donde sabemos, ninguno de los síntomas establecidos en la patología de la EA parece incompatible con el concepto de que la EA puede ser causada por hongos.
Además, los resultados decepcionantes obtenidos en ensayos clínicos en humanos diseñados para reducir la carga de ovillos de β péptido o tau no apoyan la hipótesis de la cascada amiloide [12,13,14]. Estos hallazgos sugieren que el principal agente patológico de la EA aún no se ha identificado.
La existencia de infección fúngica en pacientes con EA puede deberse a su implicación en la etiología de esta enfermedad, pero también podría ser posible que, por razones aún desconocidas, estos pacientes sean más propensos a este tipo de infección. El hecho de que sean ancianos y puedan tener una respuesta inmunitaria adaptativa deficiente, o posiblemente cambios en la dieta y los hábitos de higiene, puede contribuir a la aparición de infecciones fúngicas.
Es evidente que serán necesarios ensayos clínicos para establecer un efecto causal de la infección fúngica en la EA.
En la actualidad existen una serie de compuestos antifúngicos altamente eficaces con poca toxicidad [58,59,60,61]. Se necesita un esfuerzo combinado de la industria farmacéutica y los médicos para diseñar ensayos clínicos que prueben la posibilidad de que la EA sea causada por una infección fúngica.
* * *
ORIGINAL COMPLETO: Nature, 15 de octubre de 2015. AUTORES: Diana Pisa, Ruth Alonso, Alberto Rábano, Izaskun Rodal y Luis Carrasco. REFERENCIAS: en el original.









