Discusión
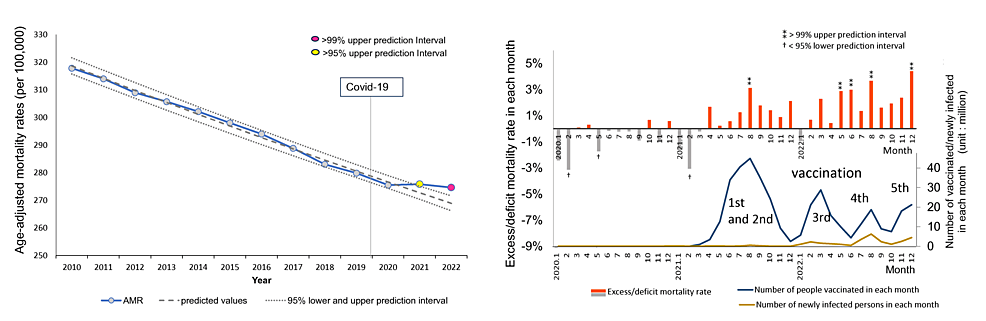
Scherb et al. estimaron que el exceso bruto de mortalidad por todas las causas durante la pandemia de COVID-19 en Japón en 2020, 2021 y 2022 fue de -2,84% (IC95%: -4,46, -1,25), 0,80% (-0,83, 2,40) y 8,37% (6,74, 9,97), respectivamente, utilizando predicciones de tendencias logísticas lineales basadas en 2005 a 2019 [5]. En nuestro estudio, estimamos el exceso de mortalidad ajustado por edad mediante regresión logística con predicciones de 2010 a 2019 y calculamos -2,3% (-2,7, -1,9), 2,1% (1,6, 2,6) y 9,6% (9,0, 10,2), respectivamente. Estos resultados parecen consistentes. Para todos los cánceres, estimamos que el exceso de mortalidad fue de -0,4% (-0,9, 0,1), 1,1% (0,5, 1,8) y 2,1% (1,4, 2,8), respectivamente, lo que indica que no hubo exceso en 2020 y aumentos estadísticamente significativos en 2021 y especialmente en 2022.
Hallazgos en 2020, durante el primer año de la pandemia
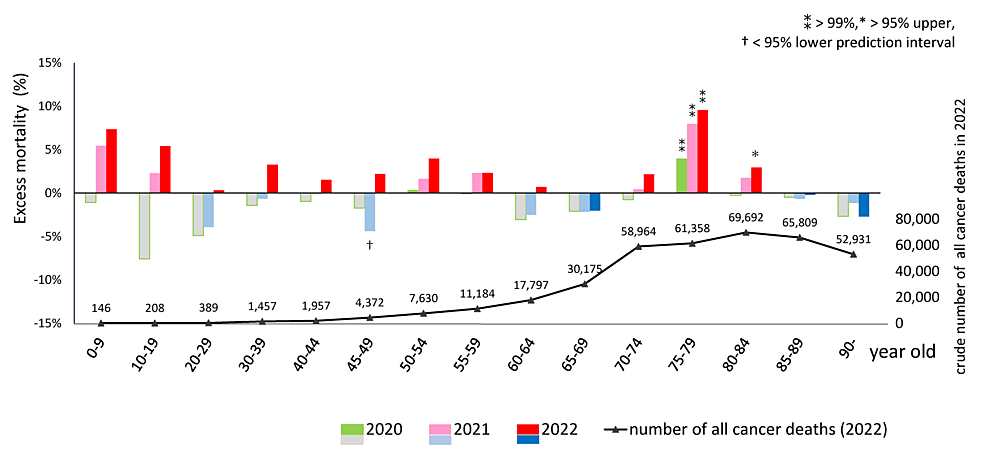
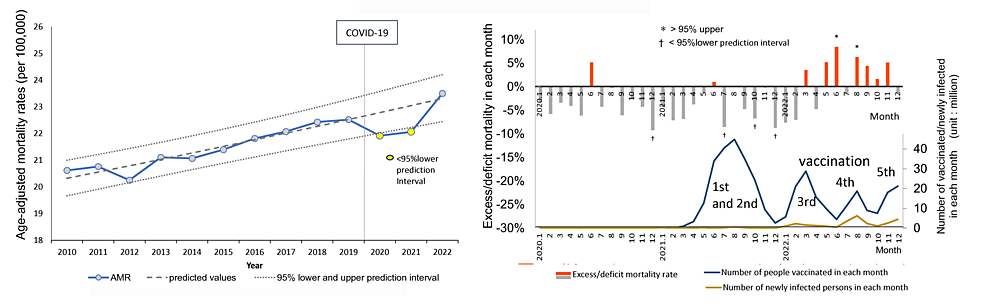
La mortalidad por todos los cánceres no aumentó en 2020. Las únicas desviaciones estadísticamente significativas de las predicciones en 2020 fueron un exceso del 3,9 % en todas las muertes por cáncer en el grupo de edad de 75 a 79 años, un exceso muy leve (0,9 %) en las muertes por cáncer de páncreas y un déficit del 3,8 % en las muertes por cáncer de mama (también se observó un déficit del 4,3 % en las muertes por cáncer de mama en 2021). En 2020, cepas altamente virulentas del SARS-CoV-2 ingresaron a Japón, pero hubo relativamente pocas muertes atribuidas a COVID-19 en Japón [21]. Las declaraciones de emergencia pandémica se emitieron tres veces antes de septiembre de 2021, solicitando el distanciamiento social y asegurando la hospitalización de los pacientes con COVID-19. En algunos países se realizaron estudios de modelización para estimar el impacto de la pandemia en la mortalidad por cáncer [7,8]. De hecho, durante la primera ola de COVID-19 en Bélgica en marzo y abril de 2020, las muertes por cáncer aumentaron un 10% y un 33%, respectivamente, en comparación con el número de muertes previstas de 2013 a 2018 [9]. En Madurai, una ciudad del sur de la India, las muertes atribuidas al cáncer aumentaron un 109% durante las primeras semanas de confinamiento [10]. En Brasil, durante la primera ola de marzo a mayo de 2020, el número de biopsias, colonoscopias, mamografías y cirugías oncológicas disminuyó un 29%, 57%, 55% y 9%, respectivamente, en comparación con las cifras previas a la pandemia. Como resultado, el número de hospitalizaciones por cáncer disminuyó en un 21%, mientras que la tasa de mortalidad de los pacientes hospitalizados con cáncer aumentó en un 14% [22]. En Japón, el número de exámenes de detección de cáncer gástrico, de pulmón, colorrectal, de mama y de útero en la comunidad disminuyó un 24,4 % (en el trabajo, solo el 0,9 %) en 2020 y parece haber vuelto a las tendencias originales en 2021 [23]. El número de cirugías significativas por cánceres gastrointestinales disminuyó un 6,2% en 2020 y un 5,1% en 2021 en comparación con las de 2018 y 2019 [23]. El declive de este tipo de atención oncológica podría explicar el exceso de mortalidad por cáncer en el grupo de edad de 75 a 79 años y el ligero aumento de las muertes por cáncer de páncreas observado en 2020 en nuestro estudio. Se desconocen las razones de la disminución de las muertes por cáncer de mama en 2020-2021.
Resultados en 2021 y 2022, segundo y tercer año de pandemia
Los resultados estadísticos sobre las muertes por cáncer en 2021-2022 se pueden resumir de la siguiente manera.
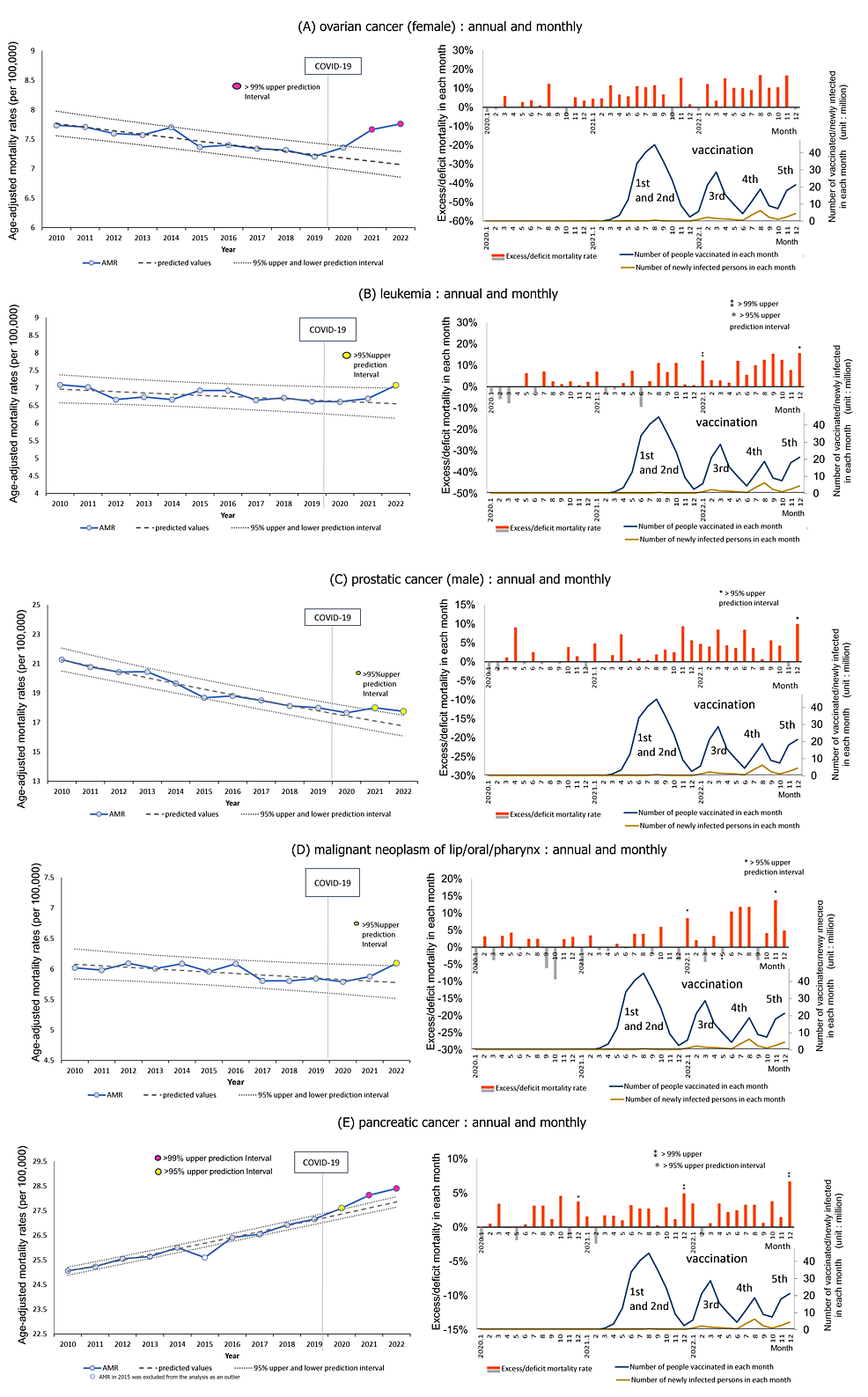
Todas las muertes por cáncer: en 2021 surgió un exceso estadísticamente significativo que aumentó aún más en 2022. Además, se observó un exceso significativo de mortalidad mensual después de agosto de 2021, mientras que la vacunación masiva de la población general comenzó alrededor de abril de 2021. Hubo tendencias excesivas en las muertes por cáncer en la mayoría de los grupos de edad. Sin embargo, estas tendencias solo fueron estadísticamente significativas para los grupos de edad con mayor mortalidad por cáncer: el grupo de 75 a 79 años en 2021 y el grupo de 75 a 84 años en 2022. Más del 90% de las personas mayores de 70 años han recibido la tercera dosis de la vacuna.
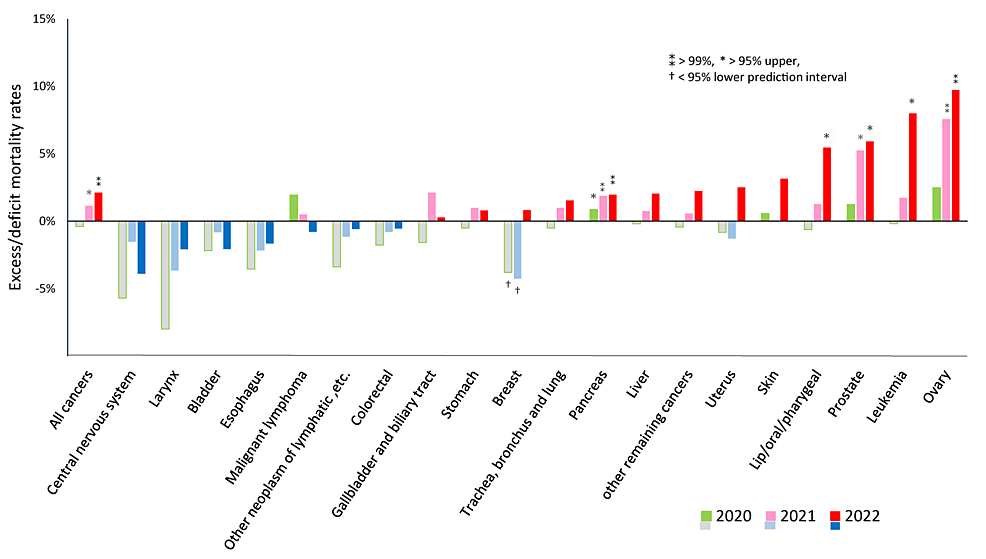
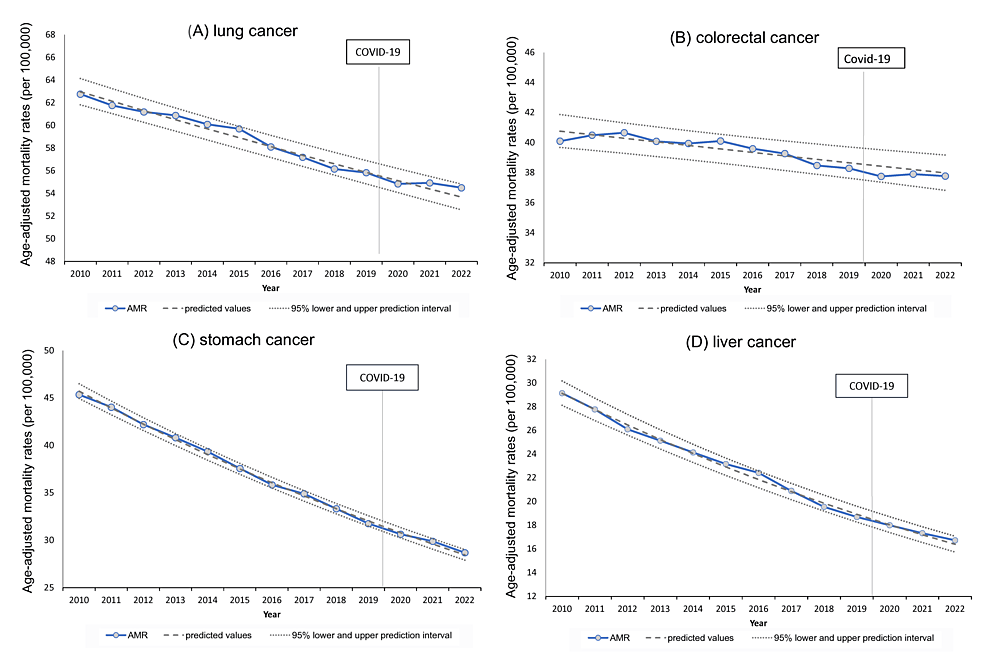
Tipo de cáncer: Las muertes por los tipos de cáncer más comunes (cáncer de pulmón, colorrectal, estómago e hígado) mostraron tendencias a la baja en el período anterior a la pandemia, y las tasas de disminución se desaceleraron durante la pandemia, pero se mantuvieron dentro del 95% de los IP. Por otro lado, seis de los 20 tipos de cáncer (cáncer de ovario, leucemia, cáncer de próstata, labio/oral/faríngeo, páncreas y mama) tuvieron un exceso de mortalidad estadísticamente significativo en 2021, que aumentó aún más en 2022. La reducción de las pruebas de detección del cáncer y de la atención médica debido al confinamiento podría aumentar las muertes por cualquier tipo de cáncer. Aun así, es poco probable que los aumentos significativos en la mortalidad de seis tipos específicos de cáncer se expliquen por la escasez de servicios de atención médica. En cuanto a las incidencias durante este período, las cifras brutas de todos los pacientes registrados en los centros de atención oncológica mostraron tendencias crecientes para el cáncer de próstata en hombres y el cáncer de mama en mujeres en 2021, especialmente en 2022 [24]. Sin embargo, estos no están ajustados por edad y no pueden juzgarse como aumentos.
Influencia de múltiples dosis de vacunas de ARNm-LNP
Sobre la base de un informe sobre la atención oncológica en el país [23] y la ausencia de una declaración de emergencia a partir de octubre de 2021, las restricciones al acceso a los exámenes de detección o al tratamiento del cáncer parecen haberse aliviado mucho después de finales de 2021. La vacunación masiva con la primera y segunda dosis comenzó en la primavera de 2021, y la tasa de vacunación pronto alcanzó su punto máximo en el verano de 2021 con el 80% de la población. La tasa de vacunación para la tercera dosis alcanzó su punto máximo en la primavera de 2022, con un 68%. Ahora, Japón incluso está llevando a cabo una vacunación masiva con una séptima dosis, lo que lo convierte en el país con las tasas de vacunación más altas.
Los investigadores han informado que la vacuna ARNm-LNP contra el SARS-CoV-2 puede presentar el riesgo de desarrollo y progresión del cáncer [25-28]. Además, en varios informes de casos se ha descrito el desarrollo o empeoramiento del cáncer después de la vacunación y se han analizado los posibles vínculos causales entre el cáncer y la vacunación con ARNm-LNP [29-34].
Con base en el peso molecular del ARNm de BNT162b2 (Pfizer-BioNTech), el contenido de ARNm por dosis se estima en 13 billones de moléculas y 40 billones de moléculas en ARNm-1273 (Moderna) [35,36]. Se estima que el número total de células en humanos es de 37,2 billones [37], lo que hace que el número de ARNm-LNP sea muy alto, oscilando entre un tercio y el equivalente al número total de células. Después de la inoculación, los ARNm-LNP se administran a varios órganos, especialmente al hígado, el bazo, la glándula suprarrenal, el ovario y la médula ósea [38]. En un estudio, se detectó ARNm de la vacuna en los ganglios linfáticos de personas vacunadas con hibridación de una sonda específica de la vacuna de ARNm del SARS-CoV-2 de 7 a 60 días después de la segunda dosis de ARNm-1273 o BNT162b2 [39]. El ARNm modificado con N1-metil-pseudouridina podría traducir una gran cantidad de proteína de pico del SARS-CoV-2 (proteína S) [40]. La proteína S emergió en la superficie de los exosomas en la sangre de los vacunados [41]. Se encontraron fragmentos de proteína S recombinante específica de la vacuna en muestras de sangre del 50% de los receptores de la vacuna y aún se detectaron de tres a seis meses después [42].
Por otro lado, en el caso de la infección por SARS-CoV-2, que es básicamente una infección respiratoria, la proteína S viral solo se detectó en suero hasta por 10-20 días, incluso en pacientes con enfermedad aguda grave [43-45]. Las cepas atenuadas de ómicron surgieron en Japón a principios de 2022 y han prevalecido en varios momentos desde entonces. Como se muestra en los gráficos de las figuras 1, 5 y 6, el número mensual de personas vacunadas fue muchas veces mayor que el de los nuevos casos confirmados de infección, y el número acumulado de personas vacunadas (380 millones) fue 13 veces mayor que el de los nuevos casos confirmados de infección (30 millones) hasta finales de 2022.
Un estudio de más de 50.000 empleados de una institución médica en los Estados Unidos observó la incidencia de la epidemia de la variante Omicron en función del número de dosis de vacunas recibidas (0, 1, 2, 3 y 4 o más dosis) durante un período de 26 semanas y mostró que el número de vacunas recibidas se correlacionó positivamente con la tasa de incidencia acumulada de COVID-19 [46]. La susceptibilidad a la infección por COVID-19 después de múltiples vacunaciones puede verse reforzada por la mejora dependiente de anticuerpos [47], la impronta inmunitaria [39,48] y la inmunosupresión [25-27]. Esto puede resultar en un riesgo de exposición a la proteína S viral además de la proteína S de la vacuna para las personas vacunadas con múltiples vacunas. Estos datos sugieren un impacto significativo en los receptores de vacunas, incluido el gran número de ARNm-LNP que se inyectan, su distribución rápida y generalizada, particularmente en órganos específicos, la cantidad de proteína S producida, su larga persistencia en el cuerpo y una mayor susceptibilidad a la infección. A continuación, consideramos cada factor que puede contribuir a la participación de la vacuna mRNA-LNP SARS-CoV-2 en el aumento de la mortalidad por todos los cánceres y algunos tipos específicos de cáncer.
Efectos trombogénicos de la proteína de la espícula y la LNP
Debido a que el cáncer a menudo conduce a la activación de la coagulación a través de varios mecanismos, una de las principales causas de mortalidad en pacientes con cáncer es la trombosis asociada al cáncer (TAC) [49-51], que se manifiesta como coagulación intravascular diseminada (CID) en su forma más extrema [52]. Por lo tanto, es razonable suponer que la tendencia adicional a la formación de trombos observada con la vacuna ARNm-LNP podría ser extremadamente peligrosa. La proteína S viral y vacunal del SARS-CoV-2, especialmente los linajes de ómicron, que tienen un potencial electropositivo sólido, podrían unirse a glicoconjugados electronegativos en las superficies de los glóbulos rojos (RBC), otras células sanguíneas y células endoteliales [53]. Se ha informado que la proteína S del SARS-CoV-2 sola se une a la enzima convertidora de angiotensina 2 (ACE2) y activa la señal del receptor de angiotensina II tipo 1 (AT1), que promueve la señalización trans de la interleucina-6 (IL-6) [54], induce el engrosamiento de la pared vascular a través de la activación de la proteína quinasa [55], deteriora la función mitocondrial [56] y genera especies reactivas de oxígeno (ROS) [57]. Un estudio reciente reveló que ciertos segmentos de la proteína S pueden inducir la formación de amiloide, una proteína fibrosa que es insoluble en agua. Esta proteína desempeña un papel importante en la coagulación de la sangre y los trastornos fibrinolíticos [58]. Los anticuerpos anti-proteína de pico se unen a las proteínas S que emergen en las superficies celulares, lo que desencadena reacciones inflamatorias autoinmunes [59-63]. Además, se ha informado que la inyección de LNP en ratones causa una fuerte inflamación [64]. Todos estos hallazgos sugieren que la vacuna ARNm-LNP contra la COVID-19 representa un riesgo de trombosis en individuos con cáncer y podría explicar el exceso de mortalidad después de la vacunación masiva.
Supresión de la inmunovigilancia del cáncer
Algunos estudios han demostrado que las respuestas al interferón tipo I (INF), que desempeñan un papel esencial en la inmunovigilancia del cáncer, se suprimen después de la vacunación con ARNm-LNP contra el SARS-CoV-2 [65,66]. Un gran número de exosomas que contienen microARN (miARN)-148a y miARN-590 se liberan de las células donde se tradujeron grandes cantidades de proteína S, y cada miARN suprime el eje peptidasa específica de ubiquitina 33 (USP33)-factor regulador de interferón (IRF9) en la microglía, que internaliza estos exosomas [67]. En una revisión, Seneff et al. explicaron que esto suprime la función del IFN tipo I y el BRCA2, que son factores críticos contra las células cancerosas [26]. La expresión del ligando de muerte programada 1 (PD-L1)/muerte celular programada 1 (PD-1) en el microambiente tumoral suprime profundamente la inmunovigilancia del cáncer [68]. Un estudio mostró que la exposición a la proteína S aumenta la expresión superficial de PD-L1 en una amplia gama de tipos de células inmunitarias y células tumorales, y de PD-1 en células T, lo que suprime la actividad de las células T CD4+ y CD8+ contra las células cancerosas [69]. Otro estudio encontró que la IgG4 no específica del cáncer inhibe las funciones efectoras del anticuerpo mediadas por la IgG1 específica del cáncer, como lo demuestra la aceleración dramática del crecimiento observada en los tumores colorrectales y de mama implantados y en los papilomas cutáneos causados por carcinógenos después de la administración local de IgG4 no específica del cáncer [70]. De acuerdo con un metaanálisis en todos los cánceres, cáncer de páncreas y linfoma, los cocientes de incidencia estandarizados (SIR) de pacientes con enfermedad relacionada con IgG4 (IgG4-RD) con respecto a la población general fueron de 2,57 (IC95%: 1,72, 3,84), 4,07 (1,04, 15,92) y 69,17 (3,91, 1.223,04), respectivamente [71]. En otro estudio, los niveles de IgG4 anti-spike aumentaron en el suero de los receptores de la vacuna de ARNm contra el SARS-CoV-2 después de la segunda dosis y aumentaron aún más después de la tercera dosis [72]. Una revisión sobre IgG4 analizó cómo la exposición a largo plazo a grandes cantidades de antígenos específicos, como los que se encuentran en las vacunas de ARNm contra el SARS-CoV-2, puede causar un crecimiento descontrolado de células cancerosas a través de un cambio de clase de IgG1 o IgG3 a IgG4 [73]. Otro estudio mostró que la liberación de IL-10 con estimulación inespecífica en sangre entera fresca de receptores de la segunda dosis de BNT162b2 o ARNm-1273 aumentó en dos semanas [74]. Estos hallazgos podrían explicar el exceso de mortalidad para todos los cánceres, especialmente el exceso de muertes por cáncer de páncreas y cáncer de mama en nuestro estudio.
Se ha demostrado que la vacuna contra el SARS-CoV-2 causa inmunosupresión y conduce a la reactivación de virus latentes como el virus de la varicela-zóster (VVZ, herpesvirus humano 3; HHV3) o herpesvirus humano 8 (HHV8) en algunos casos [75,76]. El HHV8 se considera oncogénico y puede causar sarcoma de Kaposi. Se ha notificado que el cáncer orofaríngeo es causado por el virus de Ebstein-Barr (VEB, HHV4) o el virus del papiloma humano (VPH) [77], que también puede reactivarse por una posible inmunosupresión resultante de la vacunación. Estos fenómenos también podrían ayudar a explicar el exceso de muertes por cáncer de labio/oral/faringe en 2022, cuando estaba en marcha la vacunación masiva con terceras y posteriores dosis.
Desarrollo de cáncer por la vacuna de ARNm contra el SARS-CoV-2
En nuestro estudio, los AMR de cáncer de ovario, leucemia, próstata, labio/oral/faringe, páncreas y mama aumentaron significativamente más allá de las tasas previstas, especialmente en 2022. Todos estos cánceres se conocen como cánceres sensibles al estrógeno y al receptor de estrógeno alfa (ERα) [78-83]. Una investigación reciente de Solís et al. sobre la capacidad de unión de la proteína S del SARS-CoV-2 frente a más de 9.000 proteínas humanas ha demostrado que la proteína S se une específicamente a ERα y regula al alza la actividad transcripcional de ERα. La adición de estradiol (E2) a las células de cáncer de mama humano provoca la proliferación de las células cancerosas, mientras que la adición de raloxifeno, un modulador selectivo del ERα, inhibe la proliferación. Las células del cáncer de mama crecen cuando se agrega S en lugar de E2, y la adición de raloxifeno inhibe su crecimiento. Solís et al. también mencionaron que el hallazgo de la colocalización citosólica de S-ERα puede conducir a una potenciación de la señalización de ERα unida a la membrana [84]. El ERα unido a la membrana se ha implicado en muchas vías, incluida la activación de c-Myc, que promueve el ciclo celular e impacta en el desarrollo del cáncer [85].
La transcripción mediada por ERα puede inducir roturas endógenas de doble cadena de ADN (DSB) en cánceres sensibles a RE [86]. Los estudios han demostrado que la ERα activada transcripcionalmente induce DSB por la topoisomerasa II y la formación de estructuras R-loop/G-quadruplex recientemente conocida, lo que aumenta significativamente la necesidad de BRCA1 para su reparación en células de cáncer de mama [87-89]. Un estudio mostró la translocación nuclear del ARNm y la proteína S con la señal de localización nuclear [90], y un análisis bioinformático in silico mostró interacciones entre la subunidad S2 de la proteína S y BRCA1, BRCA2 y P53 [91], lo que posiblemente resultó en su secuestro y disfunción. La posible co-ocurrencia de una alta demanda de BRCA1 para reparar el daño en el ADN causado por la transcripción activada a través de ERα unida a la proteína S, junto con la disfunción de BRCA1 secuestrada por la proteína S, plantea preocupaciones sobre el aumento del riesgo de cáncer en las células sensibles a ERα en los receptores de la vacuna contra el SARS-CoV-2 de ARN-LNP.
Como se mencionó anteriormente, también existe una gran preocupación por el riesgo de disfunción en los genes supresores del cáncer cruciales, brca2 y P53, así como BRCA1, a través de mecanismos que involucran la regulación negativa de IRF9 a través de la interferencia de miARN específico en exosomas [26] y el posible secuestro por la subunidad S2 de la proteína S en la vacuna [91]. La alteración de la actividad de BRCA1 se asocia con un mayor riesgo de cáncer de mama, útero y ovario en las mujeres y cáncer de próstata en los hombres, así como un riesgo moderadamente mayor de cáncer de páncreas tanto en hombres como en mujeres [92]. Los cánceres asociados a BRCA2 incluyen el cáncer de mama y de ovario en las mujeres, el cáncer de próstata y de mama en los hombres y la leucemia mieloide aguda en los niños [26]. Estos hallazgos son altamente consistentes con nuestros resultados.
Se están investigando otros factores que pueden contribuir al desarrollo del cáncer. Dado que las ROS endógenas causan daño oxidativo en el ADN [93], el estrés oxidativo excesivo resultante de la regulación negativa de ACE2 por la proteína S [57] puede contribuir al desarrollo del cáncer. Un estudio mostró que la regulación a la baja del receptor Mas promueve la metástasis del cáncer epitelial de ovario [94]. El receptor ACE2, unido a la proteína S después de la vacunación con ARNm-LNP, puede causar directamente una regulación negativa y la posterior disfunción del receptor Mas, lo que posiblemente conduzca a un mayor riesgo de metástasis en mujeres vacunadas con cáncer de ovario. La observación de que las LNP inyectadas se acumulan particularmente en los ovarios y la médula ósea [38] podría explicar mejor nuestros hallazgos de exceso de mortalidad por cáncer de ovario y leucemia en 2022. Según un análisis de la literatura científica sobre los receptores de hormonas sexuales en el carcinoma de células escamosas de cabeza y cuello (HNSCC), ERα desempeña varias funciones en la biopatología del HNSCC, en particular el cáncer orofaríngeo. Estos incluyen la promoción de la hipermutación del ADN, la facilitación de la integración del VPH y la cooperación con el receptor del factor de crecimiento epitelial (EGFR) [82]. Esto puede explicar el aumento de la mortalidad por cáncer de labio/oral/faringe en nuestro estudio.
Un estudio reciente demostró que el ARN del SARS-CoV-2 podría transcribirse inversamente al ADN e integrarse en el genoma de la célula humana in vitro [95]. Otro estudio informó que el ARNm transfectado en las células humanas expuestas a BNT162b2 conduce a la dessilenciación del retrotransposón endógeno elemento 1 intercalado largo (LINE-1) y a la transcripción inversa de las secuencias de ARNm de la vacuna al ADN en el núcleo [96]. Se podría esperar que la acumulación de ARNm de la vacuna y moléculas de ADN transcritas inversamente en el citoplasma induzca autoinflamación crónica, autoinmunidad, daño al ADN y riesgo de cáncer en individuos susceptibles [97].
La Administración de Alimentos y Medicamentos de los Estados Unidos (FDA, por sus siglas en inglés) afirma en su guía para la producción de vacunas virales para enfermedades infecciosas: «Existen varios mecanismos potenciales por los cuales el ADN residual podría ser oncogénico, incluida la integración y expresión de oncogenes codificados o la mutagénesis insercional después de la integración del ADN» [98]. Las directrices de la FDA son esenciales para Japón porque la autorización especial de uso de emergencia de Japón dependía de la aprobación de la FDA durante la pandemia de COVID-19 [99]. Recientemente, algunos investigadores han informado que varios lotes de vacunas de Pfizer-BioNTech y Moderna contienen una cierta cantidad de fragmentos de ADN bicatenario de vectores plásmidos residuales [100,101]. Algunos de ellos mencionaron que la cantidad de ADN residual excede los límites reglamentarios para el ADN residual establecidos por la FDA. Teniendo en cuenta estos informes y la declaración regulatoria de la FDA, se requiere más investigación para determinar si el exceso de muertes por cáncer observado después de la vacunación masiva se relacionó con el ADN residual reportado en la vacuna.
Limitaciones
Este estudio se realizó utilizando estadística descriptiva de fuentes oficiales y no ha sido validado clínicamente. Es necesario realizar más estudios estadísticos analíticos por estado de vacunación.
Conclusiones
En 2022 se observaron aumentos estadísticamente significativos en las tasas de mortalidad ajustadas por edad de todos los cánceres y de algunos tipos específicos de cáncer, a saber, el cáncer de ovario, la leucemia, el cáncer de próstata, el cáncer de labio/oral/faringe, el cáncer de páncreas y el cáncer de mama, después de que dos tercios de la población japonesa hubieran recibido la tercera dosis o más tardía de la vacuna ARNm-LNP contra el SARS-CoV-2. Estos aumentos particularmente marcados en las tasas de mortalidad de estos cánceres sensibles a ERα pueden atribuirse a varios mecanismos de la vacunación de ARNm-LNP en lugar de a la infección por COVID-19 en sí misma o a la reducción de la atención oncológica debido al confinamiento. La importancia de esta posibilidad justifica estudios adicionales. Este artículo se publicó previamente en el servidor del repositorio de Zenodo el 18 de septiembre de 2023.
AUTOR: Miki Gibo y Seiji Kojima. FUENTE: cureus.com. Artículo revisado por pares. 08 de abril de 2024.
REFERENCIAS:
- Vacunas contra el COVID-19. (2023). Consultado: 29 de febrero de 2024: https://japan.kantei.go.jp/ongoingtopics/vaccine.html.
- Msemburi W, Karlinsky A, Knutson V, Aleshin-Guendel S, Chatterji S, Wakefield J: Las estimaciones de la OMS del exceso de mortalidad asociado con la pandemia de COVID-19. Naturaleza. 2023, 613:130-7. 10.1038/s41586-022-05522-2
- Colaboradores del exceso de mortalidad por COVID-19: Estimación del exceso de mortalidad debido a la pandemia de COVID-19: un análisis sistemático de la mortalidad relacionada con COVID-19, 2020-21. Lanceta. 2022, 399:1513-36. 10.1016/S0140-6736(21)02796-3
- Msemburi W, Karlinsky A, Knutson V, Aleshin-Guendel S, Chatterji S, Wakefield J: Exceso de muertes asociadas a la pandemia de covid-19 en 2020: análisis de series temporales desagregadas por edad y sexo en 29 países de ingresos altos. Naturaleza. 2023, 613:130-7. 10.1136/bmj.n1137
- Scherb H, Hayashi K: Tasa anual de mortalidad por todas las causas en Alemania y Japón (2005 a 2022) con especial atención a la pandemia de COVID-19: hipótesis y análisis de tendencias. Med Clin Sci. 2023, 5:16-22. 10.33425/2690-5191.1077
- Kuhbandner C, Reitzner M: Estimación del exceso de mortalidad en Alemania durante 2020-2022. Cureus. 2023, 15:E39371. 10.7759/cureus.39371
- Maringe C, Spicer J, Morris M, et al.: El impacto de la pandemia de COVID-19 en las muertes por cáncer debido a retrasos en el diagnóstico en Inglaterra, Reino Unido: un estudio nacional de modelización basado en la población. Lancet Oncol. 2020, 21:1023-34. 10.1016/S1470-2045(20)30388-0
- Alagoz O, Lowry KP, Kurian AW, et al.: Impacto de la pandemia de COVID-19 en la mortalidad por cáncer de mama en los EE. UU.: estimaciones de modelos de simulación colaborativa. J Natl Cancer Inst. 2021, 113:1484-94. 10.1093/jnci/djab097
- Silversmit G, Verdoodt F, Van Damme N, De Schutter H, Van Eycken L: Exceso de mortalidad en una cohorte nacional de pacientes con cáncer durante la fase inicial de la pandemia de COVID-19 en Bélgica. Biomarcadores epidemiológicos del cáncer Prev. 2021, 30:1615-9. 10.1158/1055-9965.EPI-21-0230
- Lewnard JA, B CM, Kang G, Laxminarayan R: Causas atribuidas de exceso de mortalidad durante la pandemia de COVID-19 en una ciudad del sur de la India. Nat Commun. 2023, 14:3563. 10.1038/s41467-023-39322-7
- Tanaka H, Togawa K, Katanoda K: Impacto de la pandemia de COVID-19 en las tendencias de mortalidad en Japón: ¿un cambio en 2021? Un análisis descriptivo de los datos nacionales de mortalidad, 1995-2021. BMJ Open. 2023, 13:e071785. 10.1136/bmjopen-2023-071785
- Panel de control de muertes excesivas y exiguas en Japón. (2023). Consultado: 28 de marzo de 2024: https://exdeaths-japan.org/en/.
- Mieno MN, Tanaka N, Arai T, Kawahara T, Kuchiba A, Ishikawa S, Sawabe M: Exactitud de los certificados de defunción y evaluación de los factores para la clasificación errónea de la causa subyacente de muerte. J Epidemiol. 2016, 26:191-8. 10.2188/JEA. JE201500
- [Ministerio de Salud, Trabajo y Bienestar: e-Stat, The Vital Statistics]. (2023). Consultado: 28 de marzo de 2024: https://www.e-stat.go.jp/stat-search/files?page=1&layout=datalist&toukei=00450011&tstat=000001028897&cycle=1&tclass1=….
- [Oficina de Estadística del Ministerio del Interior y Comunicaciones: resumen de los resultados de la estimación de la población]. (2023). Consultado: 28 de marzo de 2024: https://www.stat.go.jp/data/jinsui/2.html#monthly.
- [Visualización de los datos, información sobre las infecciones por COVID-19]. (2023). Consultado: 28 de marzo de 2024: https://covid19.mhlw.go.jp/extensions/public/en/index.html.
- [Estado de los informes de presuntas reacciones adversas de las instituciones médicas en virtud de la ley de inmunización]. (2023). Consultado: 28 de marzo de 2024: https://www.mhlw.go.jp/content/10601000/001068689.pdf.
- Búsqueda y uso de estadísticas de salud. (2023). Consultado: 10 de marzo de 2024: https://www.nlm.nih.gov/oet/ed/stats/02-600.html#:~:text=Age%2Dadjusted%20rates%20were%20calculated,size%20of%20that%….
- [La población estándar para las tasas de mortalidad ajustadas por edad]. (2020). Consultado: 28 de marzo de 2024: https://www.mhlw.go.jp/toukei/saikin/hw/jinkou/kakutei20/dl/14_nencho.pdf.
- [Conjunto de datos de población estándar suavizado específico por sexo]. (2019). Consultado: 28 de marzo de 2024: https://www.mhlw.go.jp/content/10700000/000557741.pdf.
- Muertes confirmadas acumuladas por COVID-19 por millón de personas. (2020). Consultado: 11 de marzo de 2024: https://ourworldindata.org/explorers/coronavirus-data-explorer?tab=table&zoomToSelection=true&time=2020-12-31..latest….
- Fonseca GA, Normando PG, Loureiro LV, Rodrigues RE, Oliveira VA, Melo MD, Santana IA: Reducción del número de procedimientos y hospitalizaciones y aumento de la mortalidad por cáncer durante la pandemia de COVID-19 en Brasil. JCO Glob Oncol. 2021, 7:4-9. 10.1200/GO.20.00471
- [Impacto de la infección por el nuevo coronavirus en la detección y el tratamiento del cáncer (evaluación en el año fiscal 2021)]. (2023). Consultado: 28 de marzo de 2024: https://www.mhlw.go.jp/content/10901000/001046961.pdf.
- [Registro de cáncer intrahospitalario: agregado nacional de 2022]. (2024). Consultado: 28 de febrero de 2024: https://ganjoho.jp/public/qa_links/report/hosp_c/pdf/2022_report.pdf.
- Seneff S, Nigh G: ¿Peor que la enfermedad? Revisión de algunas posibles consecuencias no deseadas de las vacunas de ARNm contra la COVID-19. Int J Vacuna, teoría, Pract Res. 2021, 2:38-79. 10.56098/ijvtpr.v2i1.23
- Seneff S, Nigh G, Kyriakopoulos AM, McCullough PA: Inmunosupresión innata por vacunas de ARNm contra el SARS-CoV-2: el papel de los G-cuádruples, exosomas y microARN. Toxicol químico alimentario. 2022, 164:113008. 10.1016/j.fct.2022.113008
- Parry PI, Lefringhausen A, Turni C, Neil CJ, Cosford R, Hudson NJ, Gillespie J: ‘Espikeopatía’: la proteína de pico de COVID-19 es patógena, tanto del ARNm del virus como de la vacuna. Biomedicinas. 2023, 11:2287. 10.3390/biomedicinas11082287
- Valdés Angues R, Perea Bustos Y: La vacunación contra el SARS-CoV-2 y la hipótesis de la oncogénesis multi-hit. Cureus. 2023, 15:e50703. 10.7759/cureus.50703
- Goldman S, Bron D, Tousseyn T, et al.: Progresión rápida del linfoma angioinmunoblástico de células T después de la vacuna de refuerzo de ARNm BNT162b2: informe de un caso. Front Med (Lausana). 2021, 8:798095. 10.3389/fmed.2021.798095
- Sekizawa A, Hashimoto K, Kobayashi S, et al.: Progresión rápida del linfoma de células B de la zona marginal después de la vacunación contra la COVID-19 (BNT162b2): informe de un caso. Front Med (Lausana). 2022, 9:963393. 10.3389/fmed.2022.963393
- Zamfir MA, Moraru L, Dobrea C, et al.: Neoplasias malignas hematológicas diagnosticadas en el contexto de la campaña de vacunación de ARNm contra la COVID-19: un informe de dos casos. Medicina (Kaunas). 2022, 58:874. 10.3390/medicina58070874
- Cavanna L, Grassi SO, Ruffini L, et al.: Linfoma no Hodgkin desarrollado poco después de la vacunación de ARNm contra la COVID-19: informe de un caso y revisión de la literatura. Medicina (Kaunas). 2023, 59:157. 10.3390/medicina59010157
- Ang SY, Huang YF, Chang CT: leucemia linfoblástica aguda de células B con pH positivo que ocurre después de recibir el refuerzo de la vacuna bivalente de ARNm contra el SARS-CoV-2: informe de un caso. Medicina (Kaunas). 2023, 59:627. 10.3390/medicina59030627
- Kyriakopoulos AM, Nigh G, McCullough PA, Olivier MD, Seneff S: ¿Parálisis de Bell o un carcinoma basaloide infiltrante agresivo después de la vacunación de ARNm para COVID-19? Reporte de caso y revisión de la literatura. EXCLI J. 2023, 22:992-1011. 10.17179/excli2023-6145
- Número de moléculas de ARNm en la vacuna contra la COVID-19 de Pfizer Biontec. (2021). Consultado: 28 de marzo de 2024: https://ameblo.jp/toonomikado/entry-12667109507.html.
- McKernan K, Kyriakopoulos A, McCullough PA: Diferencias en el ARNm derivado de la replicación de la vacuna y el SARS-CoV-2: implicaciones para la biología celular y la enfermedad futura [PREPRINT]. Preprints OSF. 2021, 10.31219/osf.io/bcsa6
- Bianconi E, Piovesan A, Facchin F, et al.: Una estimación del número de células en el cuerpo humano. Ann Hum Biol. 2013, 40:463-71. 10.3109/03014460.2013.807878
- Vacuna de ARNm contra el SARS-CoV-2 (BNT162, PF-07302048). (2021). Consultado: 28 de marzo de 2024: https://www.pmda.go.jp/drugs/2021/P20210212001/672212000_30300AMX00231_I100_2.pdf.
- Röltgen K, Nielsen SC, Silva O, et al.: Impronta inmunitaria, amplitud del reconocimiento de variantes y respuesta del centro germinal en la infección y vacunación por SARS-CoV-2 en humanos. Celda. 2022, 185:1025-40.E14. 10.1016/j.cell.2022.01.018
- Kim SC, Sekhon SS, Shin WR, Ahn G, Cho BK, Ahn JY, Kim YH: Modificaciones de los elementos estructurales de la vacuna de ARNm para mejorar la estabilidad del ARNm y la eficiencia de la traducción. Toxicol de células molares. 2022, 18:1-8. 10.1007/s13273-021-00171-4
- Bansal S, Perincheri S, Fleming T, Poulson C, Tiffany B, Bremner RM, Mohanakumar T: Vanguardia: Los exosomas circulantes con la proteína de pico de Covid son inducidos por la vacunación BNT162b2 (Pfizer-BioNTech) antes del desarrollo de anticuerpos: un nuevo mecanismo para la activación inmunitaria por parte de las vacunas de ARNm. J Immunol. 2021, 207:2405-10. 10.4049/jimmunol.2100637
- Brogna C, Cristoni S, Marino G, et al.: Detección de la proteína Spike recombinante en la sangre de individuos vacunados contra el SARS-CoV-2: posibles mecanismos moleculares. Proteómica Clin Appl. 2023, 17:e2300048. 10.1002/prca.202300048
- Andersson MI, Arancibia-Carcamo CV, Auckland K, et al.: El ARN del SARS-CoV-2 detectado en productos sanguíneos de pacientes con COVID-19 no está asociado con virus infecciosos. Wellcome Open Res. 2020, 5:181. 10.12688/wellcomeopenres.16002.2
- Wölfel R, Corman VM, Guggemos W, et al.: Evaluación virológica de pacientes hospitalizados con COVID-2019. Naturaleza. 2020, 581:465-9. 10.1038/s41586-020-2196-x
- Ogata AF, Maley AM, Wu C, et al.: Perfil en serie ultrasensible de antígenos y anticuerpos del SARS-CoV-2 en plasma para comprender la progresión de la enfermedad en pacientes con COVID-19 con enfermedad grave. Clin Chem. 2020, 66:1562-72. 10.1093/CLINCHEM/HVAA213
- Shrestha NK, Burke PC, Nowacki AS, Simon JF, Hagen A, Gordon SM: Efectividad de la vacuna bivalente contra la enfermedad por coronavirus 2019. Foro Abierto Infect Dis. 2023, 10:ofad209. 10.1093/ofid/ofad209
- Liu Y, Soh WT, Kishikawa JI, et al.: Un sitio que mejora la infectividad en la proteína de pico del SARS-CoV-2 dirigida por anticuerpos. Celda. 2021, 184:3452-66.e18. 10.1016/j.cell.2021.05.032
- Vatti A, Monsalve DM, Pacheco Y, Chang C, Anaya JM, Gershwin ME: Pecado antigénico original: una revisión exhaustiva. J Autoimmun. 2017, 83:12-21. 10.1016/j.jaut.2017.04.008
- Streiff MB, Abutalib SA, Farge D, Murphy M, Connors JM, Piazza G: Actualización de las directrices para el tratamiento de la trombosis asociada al cáncer. Oncólogo. 2021, 26:E24-40. 10.1002/onco.13596
- Walker AJ, Card TR, West J, Crooks C, Grainge MJ: Incidencia de tromboembolismo venoso en pacientes con cáncer: un estudio de cohorte que utiliza bases de datos vinculadas del Reino Unido. Eur J Cáncer. 2013, 49:1404-13. 10.1016/j.ejca.2012.10.021
- Madoiwa S: [Revisiones: trombosis asociada al cáncer: diafonía entre el cáncer y el sistema de coagulación sanguínea-fibrinólisis]. Nihon Kessen Shiketsu Gakkai Shi. 2023, 34:556-65. 10.2491/jjsth.34.556
- Levi M: Coagulación intravascular diseminada en el cáncer: una actualización. Hemorragia del trombo semin. 2019, 45:342-7. 10.1055/S-0039-1687890
- Boschi C, Scheim DE, Bancod A, et al.: La proteína de pico del SARS-CoV-2 induce hemaglutinación: implicaciones para las morbilidades y terapias de COVID-19 y para los efectos adversos de las vacunas. Int J Mol Sci. 2022, 23:15480. 10.3390/ijms232415480
- Patra T, Meyer K, Geerling L, et al.: La proteína de pico del SARS-CoV-2 promueve la señalización trans de IL-6 mediante la activación de la señalización del receptor de angiotensina II en las células epiteliales. PLoS Pathog. 2020, 16:10.1371/journal.ppat.1009128
- Suzuki YJ, Nikolaienko SI, Dibrova VA, et al.: Señalización celular mediada por la proteína de pico del SARS-CoV-2 en células vasculares pulmonares. Vascul Pharmacol. 2021, 137:106823. 10.1016/j.vph.2020.106823
- Lei Y, Zhang J, Schiavon CR, et al.: La proteína de pico del SARS-CoV-2 deteriora la función endotelial a través de la regulación negativa de la ECA 2. Circ Res. 2021, 128:1323-6. 10.1161/CIRCRESAHA.121.318902
- Eguchi S, Kawai T, Scalia R, Rizzo V: Comprensión de la señalización del receptor de angiotensina II tipo 1 en fisiopatología vascular. Hipertensión. 2018, 71:804-10. 10.1161/HIPERTENSIÓNAHA.118.10266
- Nyström S, Hammarström P: Amiloidogénesis de la proteína de pico del SARS-CoV-2. J Am Chem Soc. 2022, 144:8945-50. 10.1021/jacs.2c03925
- Zin Tun GS, Gleeson D, Al-Joudeh A, Dube A: Hepatitis inmunomediada con la vacuna de Moderna, ya no es una coincidencia sino que se confirma. J Hepatol. 2022, 76:747-9. 10.1016/j.jhep.2021.09.031
- Boettler T, Csernalabics B, Salié H, et al.: La vacunación contra el SARS-CoV-2 puede provocar una hepatitis dominante de células T CD8. J Hepatol. 2022, 77:653-9. 10.1016/j.jhep.2022.03.040
- Lyons-Weiler J: Es probable que el cebado patógeno contribuya a la enfermedad grave y crítica y a la mortalidad en COVID-19 a través de la autoinmunidad. J Transl Autoimmun. 2020, 3:100051. 10.1016/j.jtauto.2020.100051
- Vojdani A, Vojdani E, Kharrazian D: Reacción de anticuerpos monoclonales humanos a las proteínas del SARS-CoV-2 con antígenos tisulares: implicaciones para las enfermedades autoinmunes. Frente Immunol. 2020, 11:617089. 10.3389/fimmu.2020.617089
- Polykretis P, Donzelli A, Lindsay JC, et al.: Reacciones inflamatorias autoinmunes desencadenadas por las vacunas genéticas COVID-19 en tejidos terminalmente diferenciados. Autoinmunidad. 2023, 56:2259123. 10.1080/08916934.2023.2259123
- Ndeupen S, Qin Z, Jacobsen S, Bouteau A, Estanbouli H, Igyártó BZ: El componente de nanopartículas lipídicas de la plataforma ARNm-LNP utilizado en estudios preclínicos de vacunas es altamente inflamatorio. iCiencia. 2021, 24:103479. 10.1016/j.isci.2021.103479
- Ivanova EN, Shwetar J, Devlin JC, et al.: La vacuna de ARNm contra la COVID-19 provoca una potente respuesta inmunitaria adaptativa sin la inflamación aguda de la infección por SARS-CoV-2. iCiencia. 2023, 26:108572. 10.1016/j.isci.2023.108572
- Föhse K, Geckin B, Zoodsma M, et al.: El impacto de la vacuna de ARNm BNT162b2 en las respuestas inmunitarias adaptativas e innatas. Clin Immunol. 2023, 255:109762. 10.1016/j.clim.2023.109762
- Mishra R, Banerjea AC: La espícula del SARS-CoV-2 se dirige al eje USP33-IRF9 a través de miR-148a exosomal para activar la microglía humana. Frente Immunol. 2021, 12:656700. 10.3389/fimmu.2021.656700
- Lipson EJ, Lilo MT, Ogurtsova A, et al.: Carcinoma de células basales: expresión del punto de control de PD-L1/PD-1 y regresión tumoral después del bloqueo de PD-1. J Immunother Cáncer. 2017, 5:23. 10.1186/s40425-017-0228-3
- Loacker L, Kimpel J, Bánki Z, Schmidt CQ, Griesmacher A, Anliker M: Aumento de la expresión superficial de PD-L1 en granulocitos y monocitos de sangre periférica después de la vacunación con ARNm del SARS-CoV2 o vacuna vectorial. Clin Chem Lab Med. 2023, 61:e17-9. 10.1515/cclm-2022-0787
- Wang H, Xu Q, Zhao C, et al.: Un mecanismo de evasión inmunitaria con IgG4 que desempeña un papel esencial en el cáncer y su implicación en la inmunoterapia. J Immunother Cáncer. 2020, 8:E000661. 10.1136/jitc-2020-000661
- Yu T, Wu Y, Liu J, Zhuang Y, Jin X, Wang L: El riesgo de malignidad en pacientes con enfermedad relacionada con IgG4: una revisión sistemática y metanálisis. Artritis Res ther. 2022, 24:14. 10.1186/s13075-021-02652-2
- Irrgang P, Gerling J, Kocher K, et al.: Cambio de clase hacia anticuerpos IgG4 no inflamatorios y específicos de la espícula después de la vacunación repetida con ARNm contra el SARS-CoV-2. Sci Immunol. 2023, 8:10.1126/sciimmunol.ade2798
- Uversky VN, Redwan EM, Makis W, Rubio-Casillas A: Los anticuerpos IgG4 inducidos por la vacunación repetida pueden generar tolerancia inmunitaria a la proteína de pico del SARS-CoV-2. Vacunas (Basilea). 2023, 11:991. 10.3390/vacunas11050991
- Gil-Manso S, Carbonell D, López-Fernández L, et al.: La inducción de altos niveles de respuestas humorales y celulares específicas al SARS-CoV-2 después de la administración de vacunas de ARNm COVID-19 requiere varios días. Frente Immunol. 2021, 12:726960. 10.3389/fimmu.2021.726960
- Katsikas Triantafyllidis K, Giannos P, Mian IT, Kyrtsonis G, Kechagias KS: Reactivación del virus de la varicela zóster después de la vacunación contra la COVID-19: una revisión sistemática de informes de casos. Vacunas (Basilea). 2021, 9:1013. 10.3390/vacunas9091013
- Chen J, Dai L, Barrett L, James J, Plaisance-Bonstaff K, Post SR, Qin Z: Las proteínas del SARS-CoV-2 y los fármacos anti-COVID-19 inducen la reactivación lítica de un virus oncogénico. Commun Biol. 2021, 4:682. 10.1038/s42003-021-02220-z
- Migliaro M, Massuh D, Infante MF, Brahm AM, San Martín MT, Ortuño D: Papel del virus de Epstein-Barr y el virus del papiloma humano en el desarrollo del cáncer orofaríngeo: una revisión de la literatura. Int J Dent. 2022, 2022:10.1155/2022/3191569
- Langdon SP, Herrington CS, Hollis RL, Gourley C: Señalización de estrógenos y su potencial como diana terapéutica en el cáncer de ovario. Cánceres (Basilea). 2020, 12:1647. 10.3390/cánceres12061647
- van Dijk AD: El papel funcional del receptor de estrógeno alfa (ERα) en la LMA; una nueva diana terapéutica potencial para el tratamiento de la leucemia mieloide aguda con reordenamiento de la inv (16) y la leucemia mieloide aguda con reordenamiento de MLL. Universidad de Groningen, Groningen, Países Bajos; 2020.
- Xue J, Yao Y, Yao Q, et al.: Funciones importantes del receptor de estrógeno alfa en la progresión tumoral y la terapia antiestrógeno del adenocarcinoma ductal pancreático. Life Sci. 2020, 260:118302. 10.1016/j.lfs.2020.118302
- Drake V, Bigelow E, Fakhry C, et al.: Asociaciones biológicas y conductuales de la positividad del receptor de estrógeno alfa en el carcinoma de células escamosas de cabeza y cuello. Oncol oral. 2021, 121:105461. 10.1016/j.oraloncology.2021.105461
- DE Oliveira Neto CP, Brito HO, DA Costa RM, Brito LM: ¿Existe un papel para los receptores de hormonas sexuales en el cáncer de cabeza y cuello? Vínculos con la infección por VPH y pronóstico. Res. Anticancerígeno 2021, 41:3707-16. 10.21873/anticanres.15162
- Jefferi NE, Shamhari A’, Noor Azhar NK, et al.: El papel de erα y erβ en el cáncer de próstata resistente a la castración y los enfoques terapéuticos actuales. Biomedicinas. 2023, 11:10.3390/biomedicinas11030826
- Solis O, Beccari AR, Iaconis D, et al.: La proteína de pico del SARS-CoV-2 se une y modula los receptores de estrógeno. Sci Adv. 2022, 8:eadd4150. 10.1126/sciadv.add4150
- Schwartz N, Verma A, Bivens CB, Schwartz Z, Boyan BD: Acciones rápidas de las hormonas esteroides a través de los receptores de membrana. Biochim Biophys Acta. 2016, 1863:2289-98. 10.1016/j.bbamcr.2016.06.004
- Williamson LM, Lees-Miller SP: La transcripción mediada por el receptor de estrógeno α induce roturas de doble cadena de ADN dependientes del ciclo celular. Carcinogénesis. 2011, 32:279-85. 10.1093/carcin/BGQ255
- Sasanuma H, Tsuda M, Morimoto S, et al.: BRCA1 asegura la integridad del genoma mediante la eliminación de los complejos patológicos de ADN topoisomerasa II inducidos por estrógeno. Proc Natl Acad Sci U S A. 2018, 115:E10642-51. 10.1073/pnas.1803177115
- Kim S, Hwang S: G-quadruplex importa en la tumorigénesis específica de tejido por deficiencia de BRCA1. Genes (Basilea). 2022, 13:391. 10.3390/genes13030391
- Stork CT, Bocek M, Crossley MP, et al.: Los bucles R cotranscripcionales son la principal causa de daño en el ADN inducido por estrógenos. Vida electrónica. 2016, 5:e17548. 10.7554/eLife.17548
- Sattar S, Kabat J, Jerome K, Feldmann F, Bailey K, Mehedi M: La translocación nuclear del ARNm y la proteína de la espícula es una característica novedosa del SARS-CoV-2. Microbiol frontal. 2023, 14:1073789. 10.3389/fmicb.2023.1073789
- Singh N, Bharara Singh A: La subunidad S2 del SARS-nCoV-2 interactúa con la proteína supresora de tumores p53 y BRCA: un estudio in silico. Trad. Oncol. 2020, 13:100814. 10.1016/j.tranon.2020.100814
- Forzar el riesgo de cáncer empoderado: riesgos de cáncer asociados a mutaciones hereditarias. (2023). Consultado: 28 de marzo de 2024: https://www.facingourrisk.org/info/hereditary-cancer-and-genetic-testing/hereditary-cancer-genes-and-risk/genes-by-na….
- Ide H, Kotera M: Glicosilasas de ADN humano implicadas en la reparación del ADN dañado oxidativamente. Biol Pharm Bull. 2004, 27:480-5. 10.1248/bpb.27.480
- Saito S, Koya Y, Kajiyama H, Yamashita M, Nawa A: El sulfato de indoxilo promueve las características metastásicas de las células de cáncer de ovario a través de la regulación negativa mediada por el receptor de hidrocarburos de arilo del receptor MAS. Lab Invest. 2023, 103:100025. 10.1016/j.labinv.2022.100025
- Zhang L, Richards A, Barrasa MI, Hughes SH, Young RA, Jaenisch R: El ARN del SARS-CoV-2 transcrito inversamente puede integrarse en el genoma de células humanas cultivadas y puede expresarse en tejidos derivados de pacientes. Proc Natl Acad Sci U S A. 2021, 118:e2105968118. 10.1073/pnas.2105968118
- Aldén M, Olofsson Falla F, Yang D, Barghouth M, Luan C, Rasmussen M, De Marinis Y: Transcripción inversa intracelular de la vacuna de ARNm BNT162b2 contra la COVID-19 de Pfizer BioNTech in vitro en una línea celular de hígado humano. Ediciones de Curr Mol Biol. 2022, 44:1115-26. 10.3390/CIMB44030073
- Acevedo-Whitehouse K, Bruno R: Riesgos potenciales para la salud de la terapia con vacunas basadas en ARNm: una hipótesis. Hipótesis médicas. 2023, 171:111015. 10.1016/j.mehy.2023.111015
- FDA: Guía para la industria: caracterización y calificación de sustratos celulares y otros materiales biológicos utilizados en la producción de vacunas virales para indicaciones de enfermedades infecciosas. (2010). Consultado: 7 de marzo de 2024: https://www.fda.gov/media/78428/download.
- [Agencia digital: e-gov: Búsqueda de Leyes y Reglamentos (Aprobación especial) Artículo 14-3]. (2024). Consultado: 28 de marzo de 2024: https://elaws.e-gov.go.jp/document?lawid=335AC0000000145.
- Audiencia del Senado de Carolina del Sur – Profesor de la USC Dr. Phillip Buckhaults. (2023). Consultado: 7 de marzo de 2024: https://jessicar.substack.com/p/south-carolina-senate-hearing-usc.
- Speicher D, Rose J, Gutschi LM, Wiseman DM, McKernan K: Fragmentos de ADN detectados en vacunas monovalentes y bivalentes Pfizer/BioNTech y Moderna modRNA COVID-19 de Ontario, Canadá: relación exploratoria de dosis-respuesta con eventos adversos graves [PREPRINT]. Preimpresión de la banda sonora. 2023, 10.31219/osf.io/mjc97