Abstracto
Debido a sus propiedades fisicoquímicas únicas, los nanomateriales de la familia del grafeno (GFN) son ampliamente utilizados en muchos campos, especialmente en aplicaciones biomédicas. Actualmente, muchos estudios han investigado la biocompatibilidad y toxicidad de los GFN en vivo y en laboratorio.
En general,
los GFN pueden ejercer diferentes grados de toxicidad en animales o modelos celulares siguiendo diferentes vías de administración y penetrando a través de barreras fisiológicas, posteriormente se distribuyen en tejidos o se localizan en células, siendo finalmente excretados fuera de los cuerpos.
Esta revisión recopila estudios sobre los efectos tóxicos de las GFN en varios órganos y modelos celulares.
También señalamos que
varios factores determinan la toxicidad de los GNF, incluido el tamaño lateral, la estructura de la superficie, la funcionalización, la carga, las impurezas, las agregaciones y el efecto corona, etc.
Además,
se han revelado varios mecanismos típicos subyacentes a la toxicidad de GFN, por ejemplo, destrucción física, estrés oxidativo, daño al ADN, respuesta inflamatoria, apoptosis, autofagia y necrosis.
En estos mecanismos, (toll-like receptors-) TLR-, factor de crecimiento transformador β- (TGF-β-) y factor de necrosis tumoral-alfa (TNF-α)
vías dependientes están involucradas en la red de vías de señalización, y el estrés oxidativo juega un papel crucial en estas vías.
En esta revisión, resumimos la información disponible sobre los factores reguladores y los mecanismos de toxicidad de las GFN, y proponemos algunos desafíos y sugerencias para futuras investigaciones de las GFN, con el objetivo de completar los mecanismos toxicológicos y proporcionar sugerencias para mejorar la seguridad biológica de las GFN y facilitar su amplia aplicación.
Antecedentes
El grafeno, que está aislado del grafito cristalino, es una monocapa plana compuesta de láminas bidimensionales de un solo átomo de espesor de una red de panal dispuesta hexagonalmente [1].
Debido a su estructura única, área de superficie específica y características mecánicas, las funciones y aplicaciones del grafeno han ganado una atención considerable desde el descubrimiento del material en 2004 [2, 3].
El grafeno y sus derivados incluyen grafeno monocapa, grafeno de pocas capas (FLG), óxido de grafeno (GO), óxido de grafeno reducido (rGO), nanoláminas de grafeno (GNS) y nanocintas de grafeno, etc. [4–7].
GO es uno de los derivados químicos de grafeno más vitales de los nanomateriales de la familia del grafeno (GNG), que atrae cada vez más atención por sus posibles aplicaciones biomédicas.
Los materiales a base de grafeno generalmente tienen tamaños que van desde varios a cientos de nanómetros y tienen un grosor de 1-10 nm [8, 9], que también es la definición de «nanopartículas» o «nanomateriales».
Debido a sus excepcionales propiedades físicas y químicas, los materiales de grafeno se han utilizado ampliamente en diversos campos, incluido el almacenamiento de energía; dispositivos nanoelectrónicos; baterías [10–12]; y aplicaciones biomédicas, como antibacterianos [13, 14], biosensores [15–18], imágenes celulares [19, 20], administración de fármacos [8, 21, 22] e ingeniería de tejidos [23–25].
Junto con el aumento de la aplicación y producción de GNG, aumenta el riesgo de exposición ocupacional o ambiental no intencional a las GFN [26]. Y recientemente, hay algunas investigaciones sobre la exposición a las GFN en entornos ocupacionales y los datos publicados mostraron que la exposición ocupacional de las GFN tenía toxicidad potencial para los trabajadores e investigadores [27–29].
- Las NG se pueden administrar en los cuerpos mediante instilación intratraqueal [30], administración oral [31], inyección intravenosa [32], inyección intraperitoneal [33] e inyección subcutánea [34].
- Las GFN pueden inducir lesiones agudas y crónicas en los tejidos al penetrar a través de la barrera sangre-aire, la barrera sangre-cerebro (hematoencefálica), la barrera sangre-testículos y la barrera sangre-placenta, etc. y acumularse en el pulmón, el hígado y el bazo, etc.
Por ejemplo,
algunos aerosoles de nanomateriales de grafeno pueden inhalarse y deposición sustancial en el tracto respiratorio, y pueden penetrar fácilmente a través de las vías respiratorias traqueobronquiales y luego transitar hacia las vías respiratorias pulmonares inferiores, lo que resulta en la posterior formación de granulomas, fibrosis pulmonar y efectos adversos para la salud de las personas expuestas [2, 29].
Varias revisiones han descrito las propiedades únicas [35, 36] y resumido las últimas aplicaciones biológicas potenciales de las GFN para la administración de fármacos, la administración de genes, los biosensores, la ingeniería de tejidos y la neurocirugía [37–39]; evaluó la biocompatibilidad de los GNF en células (bacterianas, de mamíferos y plantas) [7, 40, 41] y animales (ratones y peces cebra) [42]; recopiló información sobre la influencia de los GNG en los ambientes del suelo y el agua [43]. Aunque estas revisiones discutieron los perfiles de seguridad relacionados y la nanotoxicología de los GFN, las conclusiones específicas y los mecanismos detallados de toxicidad fueron insuficientes, y los mecanismos de toxicidad no se resumieron completamente.
Los mecanismos toxicológicos de las GFN demostradas en estudios recientes contienen principalmente respuesta inflamatoria, daño al ADN, apoptosis, autofagia y necrosis, etc.,
y esos mecanismos se pueden recopilar para explorar más a fondo la compleja red de vías de señalización que regulan la toxicidad de las GFN.
Es necesario señalar que hay varios factores que influyen en gran medida en la toxicidad de los GFN, como la concentración, la dimensión lateral, la estructura de la superficie y la funcionalización, etc. A continuación, esta revisión presenta un resumen completo de la información disponible sobre los mecanismos y factores reguladores de la toxicidad de las GFN in vitro e in vivo a través de diferentes métodos experimentales, con el objetivo de proporcionar sugerencias para estudios adicionales de las GFN y completar los mecanismos toxicológicos para mejorar la seguridad biológica de las GFN y facilitar su amplia aplicación.
Toxicidad de las GFN (in vivo e in vitro)
Los GFN penetran a través de las barreras fisiológicas o estructuras celulares por diferentes vías de exposición o vías de administración y entran en el cuerpo o las células, lo que eventualmente resulta en toxicidad in vivo e in vitro.
Las diferentes vías de administración y vías de entrada, la diferente distribución y excreción de tejidos, incluso los diversos patrones y ubicaciones de captación celular, pueden determinar el grado de toxicidad de los GNF [44–46].
Por lo tanto, dejarlos claros puede ser útil para comprender mejor las leyes de la aparición y el desarrollo de la toxicidad de las GFN.
Vía de administración
Las vías de administración comunes en modelos animales incluyen la exposición de las vías respiratorias (insuflación intranasal, instilación intratraqueal e inhalación), la administración oral, la inyección intravenosa, la inyección intraperitoneal y la inyección subcutánea.
La principal vía de exposición de las GFN en el entorno de trabajo es la exposición de las vías respiratorias,
por lo que la inhalación y la instilación intratraqueal se utilizan principalmente en ratones para simular la exposición humana a las GFN.
Aunque el método de inhalación proporciona la simulación más realista de la exposición a la vida real, la instilación es un método más efectivo y que ahorra tiempo, y se encontró que las GFN causan un período de inflamación más largo mediante instilación (instilación intratraqueal, instalación intrapleural y aspiración faríngea) que la inhalación [24, 30, 47, 48 ].
Se investigó que los GNG se depositaban en los pulmones y se acumulaban a un nivel alto, que se retenía durante más de 3 meses en los pulmones con un aclaramiento lento después de la instilación intratraqueal [49].
La inyección intravenosa también se usa ampliamente para evaluar la toxicidad de los nanomateriales de grafeno, y
el grafeno circula a través del cuerpo de ratones en 30 minutos, acumulándose a una concentración de trabajo en el hígado y la vejiga [32, 50–52].
Sin embargo,
los derivados de GO tuvieron una adsorción intestinal bastante finita y se excretaron rápidamente en ratones adultos mediante administración oral [31, 53].
El GO de tamaño nanométrico (350 nm) causó que menos células mononucleares se infiltraran en el tejido adiposo subcutáneo después de la inyección subcutánea en la región del cuello en comparación con el GO del tamaño de micras (2 μm) [34].
GO aglomerado cerca del sitio de inyección después de la inyección intraperitoneal, y numerosos agregados más pequeños se asentaron en la proximidad de la serosa hepática y del bazo [31, 33].
Los experimentos sobre el contacto con la piel o la permeabilidad de la piel a los GFN no se encontraron en los artículos revisados aquí, y no hay pruebas suficientes disponibles para concluir que el grafeno puede penetrar en la piel intacta o las lesiones cutáneas.
La ruta de las gotas nasales, que se ha utilizado ampliamente para probar la neurotoxicidad o el potencial de lesión cerebral de otros nanomateriales, no se mencionó en los artículos revisados aquí.
Rutas de entrada de GFN
Los GNF llegan a varios lugares a través de la circulación sanguínea o barreras biológicas después de ingresar al cuerpo, lo que resulta en diversos grados de retención en diferentes órganos.
Debido a su tamaño nanométrico,
los GNF pueden llegar a órganos más profundos al pasar a través de las barreras fisiológicas normales, como la barrera aire-sangre, la barrera sangre-testicular, la barrera hematoencefálica y la barrera sangre-placentaria.
Barrera aire-sangre
Los pulmones son una entrada potencial para las nanopartículas de grafeno en el cuerpo humano a través de las vías respiratorias.
Las nanoláminas de GO inhaladas pueden destruir la ultraestructura y las propiedades biofísicas de la película de surfactante pulmonar (PS),
que es la primera línea de defensa del huésped, y emerger su toxicidad potencial [54].
Las partículas aglomeradas o dispersas se depositan en la superficie alveolar interna dentro de los alvéolos y luego son engullidas por macrófagos alveolares (AM) [55].
El aclaramiento en los pulmones es facilitado por la escalera mecánica mucociliar, las AM o la capa epitelial [56–58].
Sin embargo,
algunas nanopartículas pequeñas e inhaladas se infiltran en la barrera epitelial pulmonar intacta y luego pueden ingresar transitoriamente al epitelio alveolar o al intersticio [59, 60].
El grafeno inoculado intratraquealmente puede redistribuirse al hígado y al bazo al pasar a través de la barrera aire-sangre [61]. El estudio de la barrera aire-sangre puede llamar la atención intensivamente, ya que los investigadores y trabajadores se exponen ocupacionalmente a los GNF generalmente por inhalación. Intentar aclarar cómo la barrera aire-sangre juega un papel en la toxicidad de las GFN puede convertirse en un tema candente de investigación.
Barrera sangre-cerebro (hematoencefálica)
La intrincada disposición de la barrera hematoencefálica, que consiste en un número de receptores de membrana y portadores altamente selectivos, solo ejerce una influencia sutil en la circulación sanguínea y el microambiente cerebral en comparación con el endotelio vascular periférico [62]. La investigación sobre el mecanismo de la barrera hematoencefálica ha hecho algunos progresos relacionados con las enfermedades y la nanotoxicidad. La imagen de espectrometría de masas (MSI) de desorción/ionización láser asistida por matriz (MALDI) reveló que rGO, con un diámetro promedio de 342 ± 23,5 nm, penetró a través de la vía paracelular hacia la hendidura interendodottelial de una manera dependiente del tiempo al disminuir la tensión paracelular de la barrera hematoencefálica [63].
Además,
los puntos cuánticos de grafeno (GQD), con un tamaño pequeño de menos de 100 nm, pueden cruzar a través de la barrera hematoencefálica [64].
Los estudios sobre cómo los materiales de grafeno pasan a través de la barrera hematoencefálica y causan neurotoxicidad son muy raros, y se necesitan más datos para sacar una conclusión.
Barrera sangre-testículos
Las barreras de los testículos sanguíneos y del epidídimo sanguíneo son bien conocidas por ser algunas de las barreras más estrechas entre los tejidos sanguíneos y el cuerpo de los mamíferos [65]. Las partículas de GO con diámetros de 54,9 ± 23,1 nm tuvieron dificultades para penetrar en las barreras de los testículos sanguíneos y el epidídimo sanguíneo después de la inyección intraabdominal, y la calidad del esperma de los ratones no se vio obviamente afectada incluso a una dosis de 300 mg / kg [66].
Barrera sangre-placenta
La barrera placentaria es indispensable para mantener el embarazo, ya que media el intercambio de nutrientes y productos de desecho metabólicos, ejerce funciones metabólicas vitales y secreta hormonas [67].
Una revisión reciente sugirió que
la placenta no proporciona una barrera estrecha contra la transferencia de nanopartículas a los fetos,
específicamente contra la distribución de nanopartículas carbonáceas hacia y en el feto [42].
Se sugirió que las partículas de rGO y oro (diámetro de 13 nm) apenas están presentes o están ausentes en la placenta y el feto al final de la gestación después de la inyección intravenosa [44, 68]. Sin embargo,
otros informes mostraron que la transferencia transplacentaria ocurre en etapas gestacionales tardías [69, 70].
Se había prestado mucha atención a la toxicidad para el desarrollo de los nanomateriales, y
los informes mostraron que muchas nanopartículas cruzaron la barrera placentaria e influyeron fuertemente en el desarrollo de embriones [71-75].
Pero los estudios de la exposición a materiales de grafeno a través de la barrera placentaria son deficientes, y la forma en que estas partículas se transfieren a los embriones debe evaluarse en detalle en el futuro.
Estas cuatro barreras fueron las barreras más mencionadas en la literatura, y otras barreras no se han evaluado en estudios recientes, como las barreras cutáneas, que no se han mencionado en ninguno de los cientos de estudios de toxicidad de GFN buscados. Además, el mecanismo por el cual las GFN atraviesan estas barreras no se comprende bien, y se necesitan urgentemente investigaciones más sistemáticas.
Distribución y excreción de GFN en el tejido
La absorción, distribución y excreción de nanopartículas de grafeno puede verse afectada por diversos factores, incluidas las vías de administración, las propiedades fisicoquímicas, la aglomeración de partículas y el recubrimiento superficial de las GNF.
Las diferentes vías de administración influyen en la distribución de las GFN, por ejemplo, la FLG instilada intratraquealmente que pasa
a través de la barrera aire-sangre se acumuló principalmente y se retuvo en los pulmones, con un 47 % restante después de 4 semanas [61].
La GO administrada por vía intravenosa ingresó al cuerpo a través de la circulación sanguínea y
se retuvo en gran medida en el pulmón, el hígado, el bazo y la médula ósea, y se observó infiltración de células inflamatorias, formación de granuloma y edema pulmonar en los pulmones de ratones después de la inyección intravenosa de 10 mg kg / peso corporal GO [49].
Del mismo modo, se observó una alta acumulación de derivados de GO PEGilados en el sistema reticuloendotelial (RES), incluyendo el hígado y el bazo después de la inyección intraperitoneal.
En contraste,
GO-PEG y FLG no mostraron absorción detectable del tracto gastrointestinal o absorción de tejido a través de la administración oral [31].
Las diferentes propiedades de los GFN, como su tamaño, dosis y grupos funcionales, siempre conducen a resultados inconsistentes en los perfiles de distribución del grafeno. Por ejemplo, Zhang et al. encontraron que el GO estaba atrapado principalmente en los pulmones de los ratones [49]; sin embargo, Li et al. observaron que el GO se acumuló en el hígado de ratón [76].
En particular,
las hojas pequeñas de GO, con diámetros de 10-30 nm, se distribuyeron principalmente en el hígado y el bazo, mientras que las hojas de GO más grandes (10-800 nm) se acumularon principalmente en los pulmones [49, 52, 77].
Si el tamaño de GO es mayor que el tamaño de los vasos, GO generalmente se atasca en las arterias y capilares en las proximidades del sitio de inyección. Se demostró que la acumulación de GO en los pulmones aumenta con un aumento en la dosis y el tamaño inyectados, pero eso en el hígado disminuyó significativamente [78].
El recubrimiento de polímeros biocompatibles en GO también afecta la biodistribución, por ejemplo, la inyección intravenosa de GO-PEG y GO-dextrano (GO-DEX) que se acumulan en el sistema reticuloendotelial (RES), incluidos el hígado y el bazo, sin toxicidad a corto plazo [31, 79].
Además, la carga de proteínas plasmáticas y la adsorción de GO por proteínas plasmáticas también afecta a la biodistribución [34].
La excreción y el aclaramiento de las GFN varían en diferentes órganos.
En los pulmones, las observaciones indicaron que las ONG son atraídas y eliminadas por las AM, que podrían eliminarse del esputo a través del aclaramiento mucociliar u otras formas [57], y el 46,2 % de la FLG instilada intra-traquealmente se excretó a través de las heces 28 d después de la exposición [61].
En el hígado, las nanopartículas se pueden eliminar a través de la vía hepatobiliar que sigue el conducto biliar hacia el duodeno [80]. Además, el GNS PEGilado que se acumula principalmente en el hígado y el bazo puede eliminarse gradualmente, probablemente por excreción renal y fecal. Como se revisó recientemente, las láminas de GO de más de 200 nm están atrapadas por la filtración física esplénica, pero los tamaños pequeños (aproximadamente 8 nm) pueden penetrar los túbulos renales en la orina y eliminarse rápidamente sin toxicidad obvia [81].
Las vías de excreción de los GFN aún no se han explicado claramente, pero las rutas renales y fecales parecen ser las principales vías de eliminación del grafeno.
Recientemente, la estrategia de distribución y excreción/toxicidad se ha convertido en una parte importante de los estudios nanotoxicológicos. Hasta la fecha, se han reportado varios resultados controvertidos con respecto a la distribución y excreción de grafeno in vivo en varios artículos, y aún se necesita una evaluación sistemática de la toxicocinética de las GFN.
El metabolismo y la excreción de nanomateriales son procesos de largo plazo, sin embargo, los estudios recientes de GFN se han limitado a evaluaciones toxicológicas a corto plazo, y la acumulación y toxicidad a largo plazo de GFN en diferentes tejidos sigue siendo desconocida.
Por lo tanto, es necesario realizar estudios a largo plazo sobre la deposición y excreción de GFN utilizando diferentes células y animales para garantizar la bioseguridad de los materiales antes de su utilización en aplicaciones biomédicas humanas.
Captación y localización de las GFN en células
También se ha observado que la captación y localización de las GFN ejercen diferentes efectos en diferentes líneas celulares. El grafeno se absorbe en las células a través de varias rutas [82, 83]. Básicamente, los parámetros fisicoquímicos como el tamaño, la forma, el recubrimiento, la carga, el diámetro hidrodinámico, el punto isoeléctrico y el gradiente de pH son importantes para permitir que GO pase a través de la membrana celular [84].
Como se indicó anteriormente,
las nanopartículas con diámetros <100 nm pueden ingresar a las células, y aquellas con diámetros <40 nm pueden ingresar al núcleo [85].
Por ejemplo, los GQD posiblemente penetran en las membranas celulares directamente, en lugar de a través de vías dependientes de la energía [86, 87]. Las nanopartículas de óxido de grafeno recubiertas de proteínas (PCGO) más grandes (~ 1 μm) ingresan a las células principalmente a través de la fagocitosis, y las nanopartículas de PCGO más pequeñas (~ 500 nm) ingresan a las células principalmente a través de la endocitosis mediada por clatrina [88].
Las láminas de GO podrían adherirse y envolverse alrededor de la membrana celular, insertarse en la bicapa lipídica o internalizarse en la célula como consecuencia de las interacciones con las células [89].
Del mismo modo, se demostró que el óxido de grafeno reducido (PrGO) y el rGO de PEGylated se adhieren a la membrana celular de la bicapa lipídica de manera prominente debido a la interacción de los dominios grafíticos hidrofóbicos y no modificados con la membrana celular [90, 91]. En consecuencia, se sugirió que
la exposición prolongada o una alta concentración de grafeno induce daño físico o biológico a la membrana celular, junto con la desestabilización de los filamentos de actina y el citoesqueleto [92].
Los datos actuales demuestran que las láminas de GO interactúan con la membrana plasmática y son fagocitadas por macrófagos. Tres receptores principales en los macrófagos participan en la fagocitosis de GNS: el receptor Fcg (FcgR), el receptor de manosa (MR) y el receptor del complemento (CR). Además, FcgR es un receptor clave en la vía fagocítica mediada [90, 93, 94].
La proteína corona de GO promueve el reconocimiento por parte de los receptores de macrófagos, especialmente la IgG contenida dentro de la proteína corona. Se observó que los macrófagos sufrían cambios morfológicos prodigiosos al entrar en contacto con GO [34].
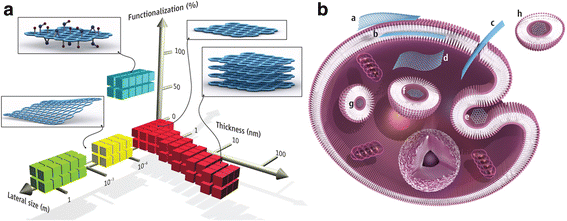
Después de la internalización, el grafeno se acumuló en el citoplasma celular, el espacio perinuclear y el núcleo, lo que indujo citotoxicidad en macrófagos murinos al aumentar las ROS intracelulares a través del agotamiento del potencial de la membrana mitocondrial y al desencadenar la apoptosis a través de la activación de la vía mitocondrial [83]. Las posibles interacciones y sitios de acumulación de GFN se resumen en la Fig. 1.
Materiales de grafeno y sus interacciones biológicas. (A) Un espacio de parámetros para los materiales de grafeno más utilizados puede describirse por las dimensiones y la funcionalización de la superficie del material, esta última definida como el porcentaje de los átomos de carbono en la hibridación sp3. Los cuadrados verdes representan el grafeno cultivado epitaxialmente; grafeno amarillo, exfoliado mecánicamente; grafeno rojo, exfoliado químicamente; azul, óxido de grafeno. Tenga en cuenta que una serie de otros materiales relacionados con el grafeno (como los puntos cuánticos de grafeno y las nanocintas de grafeno) también se están utilizando en experimentos. (B) Posibles interacciones entre materiales relacionados con el grafeno con células (las escamas de grafeno no son a escala). a) Adhesión a la superficie externa de la membrana celular. b) Incorporación entre las monocapas de la bicapa lipídica de la membrana plasmática. c) Translocación de membrana. d) Internalización citoplasmática. e) Endocitosis mediada por clatrina. f) Internalización endosomal o fagosomal. g) Localización lisosomal u otro compartimento perinuclear. h) Localización exosomal. Los resultados biológicos de tales interacciones pueden considerarse adversos o beneficiosos, dependiendo del contexto de la aplicación biomédica particular. Diferentes materiales relacionados con el grafeno tendrán diferentes mecanismos preferenciales de interacción con células y tejidos que en gran medida esperan ser descubiertos. [90] Derechos de autor (2014), con permiso de la Asociación Americana para el Avance de la Ciencia
Toxicidad de las GFN en órganos
La toxicidad y biocompatibilidad de los GGNA se ha observado y evaluado a través de estudios teóricos y de modelos animales.
En la actualidad,
hay una gran cantidad de datos que demuestran la toxicidad de los GFN en diferentes órganos o sistemas en animales, por lo que es difícil enumerar todos los datos en esta revisión.
Por lo tanto, resumimos un cierto número de literatura y elegimos algunos estudios toxicológicos in vivo de GFN enumerados en la Tabla 1.
Tabla 1 Toxicidad de las GFN en órganos: Tabla a tamaño completo
Toxicidad en órganos internos
GO puede resultar en una respuesta inflamatoria aguda y una lesión crónica al interferir con las funciones fisiológicas normales de órganos importantes [32, 81].
Los experimentos de sonda oral no mostraron una absorción detectable de GO a través del tracto gastrointestinal [95]. Curiosamente, una dosis baja de GO causó un daño grave al tracto gastrointestinal después de que los ratones maternos bebieron una suspensión de GO, en lugar de una dosis alta de GO, porque
una dosis baja de GO sin aglomeración puede adherirse fácilmente a la superficie gastrointestinal y causar destrucción a través de sus abundantes bordes afilados [53].
Las GFN
causaron inflamación y permanecieron en el pulmón el día 90 después de una sola instilación intratraqueal, e incluso se translocaron a los ganglios linfáticos pulmonares mediante inhalación solo por la nariz [96, 97].
Una dosis alta de GO que
forma agregaciones puede bloquear los vasos sanguíneos pulmonares y provocar disnea [50, 98], y se observaron trombos plaquetarios en altas concentraciones de 1 y 2 mg / kg de peso corporal mediante inyección intravenosa [89].
Según los informes,
GO interrumpió la barrera alveolar-capilar, permitiendo que las células inflamatorias se infiltren en los pulmones y estimulen la liberación de citoquinas proinflamatorias [99].
La fibrosis y la inflamación podrían verificarse por el aumento de los niveles de los marcadores proteicos colágeno1, Gr1, CD68 y CD11b en los pulmones. Se sugirió que el uso de Tween 80 para dispersar FLG o un surfactante plurónico para dispersar el grafeno reduce la probabilidad de formación de fibrosis pulmonar en células o ratones, mientras que la fibrosis pulmonar se observó cuando el grafeno se suspendió con albúmina sérica bovina (BSA) [100].
Además, los isótopos radiactivos pueden ser entregados a los pulmones, acompañados de una distribución de profundidad de 125I-NGO en los pulmones, y los isótopos podrían depositarse allí y dar lugar a mutaciones y cánceres [30].
Sin embargo, publicaciones recientes afirmaron que no hubo cambios patológicos obvios en ratones expuestos a dosis bajas de GO y grafeno funcionalizado por inyección intravenosa, incluyendo GO (GO-NH2) nominado, GO funcionalizado poli(acrilamida) (GO-PAM), GO funcionalizado poli(ácido acrílico) (GO-PAA) y GO-PEG; sólo GO-PEG y GO-PAA indujeron menos toxicidad que el GO prístino in vivo [31, 79, 89].
Por lo tanto, los grupos funcionales de GFN y la concentración de trabajo o el estado agregado influyen en gran medida en la toxicidad de los GFN. Recientemente, las formas de modificar el grupo funcional de GFN, disminuir la concentración de trabajo o cambiar la condición de agregado se utilizan generalmente para disminuir la toxicidad de los GFN.
Toxicidad en el sistema nervioso central
El grafeno ha beneficiado en gran medida a la neurocirugía con la aplicación de la administración de fármacos / genes para el tratamiento de tumores cerebrales, dispositivos biocompatibles intracraneales y espinales, técnicas de biodetección y bioimagen.
Han surgido estudios sobre las potencialidades o riesgos del grafeno en el cerebro.
En el modelo de embrión de pollo,
las escamas de grafeno prístinas disminuyeron el nivel de ácido ribonucleico y la tasa de síntesis de ácido desoxirribonucleico, lo que provocó efectos nocivos en el desarrollo del tejido cerebral y se observó la ultraestructura atípica en el cerebro [101].
Las investigaciones recientes de GFN en el sistema nervioso central están involucradas principalmente en la aplicación en lugar de la toxicidad. Los datos del estudio tóxico sobre los GNG están en marcha.
Toxicidad en el sistema de reproducción y desarrollo
El grafeno prístino redujo la vascularización del corazón y la densidad de los vasos ramificados después de la inyección en huevos de gallina fertilizados seguidos de la incubación durante 19 días [101].
GO y rGO dañan los embriones de pez cebra al influir en la tasa de eclosión del embrión y la longitud del cuerpo de una manera dependiente de la concentración. Aunque no se observó ninguna malformación o mortalidad obvia en embriones de pez cebra expuestos [102], GO se adhirió y se envolvió en el corion de los embriones de pez cebra, causando una notable hipoxia y retraso en la eclosión. Los agregados de GO se retuvieron en muchos orgánulos, como los ojos, el corazón, el saco vitelino y la cola de los embriones, y se observó apoptosis y generación de especies reactivas de oxígeno (ROS) en estas regiones [103].
Las GFN ejercen diferentes efectos toxicológicos sobre el sistema reproductor masculino o femenino.
Los datos mostraron que el GO ejerció efectos tóxicos muy bajos o casi nulos sobre la reproducción masculina, incluso a una dosis alta a través de la inyección intraabdominal [66]. Además, rGO no cambió los niveles séricos de estrógeno de ratones hembra no embarazadas.
La condición es diferente en el ratón hembra: las presas de ratón podrían dar a luz a crías sanas después de la inyección de rGO antes del apareamiento o durante la gestación temprana, y solo unos pocos fetos anormales estaban presentes entre las camadas de presas inyectadas con rGO.
Sin embargo,
los ratones preñados tuvieron abortos en todas las dosis, y la mayoría de los ratones preñados murieron cuando se inyectó la dosis alta de rGO durante la gestación tardía [44].
En particular,
el desarrollo de la descendencia en el grupo de dosis alta se retrasó durante el período de lactancia.
La alta dosis de GO
disminuyó el consumo de agua de los ratones maternos por exposición oral, lo que redujo la producción de leche y, por lo tanto, pospuso el crecimiento de la descendencia [53].
Aunque los hallazgos indican que los GNF son potencialmente dañinos para el desarrollo, los datos sobre la toxicidad para la reproducción y el desarrollo siguen siendo deficientes. Todavía se requieren estudios de la influencia de las GFN en la reproducción y el desarrollo masculino y femenino para dilucidar el mecanismo de toxicidad subyacente.
Influencia de la hemocompatibilidad
La liberación de GO en la sangre es inevitable. Se encontró que la hemocompatibilidad de GO dependía del recubrimiento funcional y de las condiciones de exposición. GO con tamaño submicrométrico resultó en la mayor actividad hemolítica, mientras que el grafeno agregado indujo la reacción hemolítica más baja. El grafeno prístino y el GO demostraron un efecto hemolítico de hasta 75 μg/ml [104]. La GO-polietilenimina (GO-PEI) mostró una toxicidad notable al unirse a HSA, incluso a 1,6 μg/ml [105].
El óxido de grafeno carboxilado (GO-COOH) mostró una citotoxicidad significativa hacia los linfocitos T en concentraciones superiores a 50 μg/ml y tuvo una buena biocompatibilidad por debajo de 25 μg/mL, mientras que el GO-quitosano casi inhibió la actividad hemolítica [106]. Hasta ahora, el riesgo correspondiente de hemocompatibilidad ha permanecido en gran parte desconocido.
En conclusión,
la lesión pulmonar inducida por las GFN ha sido estudiada en varios estudios, cuyos resultados han demostrado infiltración de células inflamatorias, edema pulmonar y formación de granulomas en los pulmones.
Sin embargo, solo unos pocos estudios específicos han evaluado en otros órganos, como el hígado, el bazo y el riñón, y los síntomas de lesión, el índice de daño y el nivel de daño a estos órganos internos no se investigaron completamente.
Además, los estudios sobre la neurotoxicidad de las GFN son bastante raros; no hay datos que revelen qué nervios o áreas cerebrales experimentan daños, ni se han estudiado las manifestaciones conductuales relacionadas.
La toxicidad para el desarrollo de los GNF puede inducir anomalías estructurales, retraso del crecimiento, anomalías conductuales y funcionales, e incluso la muerte.
Un estudio sobre la toxicidad reproductiva y para el desarrollo de las GFN será extremadamente significativo y ganará amplia atención en el futuro.
Casi todos los estudios de toxicidad de GFN fueron experimentos de período corto, y ningún estudio ha investigado la lesión tóxica crónica a largo plazo.
Sin embargo,
según los estudios de toxicidad de otros nanomateriales, la exposición a largo plazo a GFN puede ser un factor importante que perjudica la salud [107–109].
Por lo tanto, el estudio a largo plazo de los GNG es necesario.
Toxicidad de las GFN en modelos celulares
La citotoxicidad de los GNF in vitro se ha verificado en varias células para cambiar la viabilidad y morfología celular, destruir la integridad de la membrana e inducir daño al ADN [110–112]. GO o rGO disminuyen la adhesión celular; inducir apoptosis celular; y entran en lisosomas, mitocondrias, núcleos celulares y endoplasma [113]. Los GQD ingresaron a las células e indujeron daño en el ADN por el aumento de la expresión de las proteínas p53, Rad 51 y OGG1 en las células T3 NIH-3 [87]. Sin embargo, los GQD no presentaron toxicidad significativa para las líneas celulares de cáncer de mama humano (a una dosis de 50 μg/ml) o las células madre neurales humanas (a una dosis de 250 μg/ml) [114, 115]. Los derivados de GO disminuyeron drásticamente la expresión de genes diferenciales que son responsables de la estructura y función de la membrana celular, como la regulación del citoesqueleto de actina, la adhesión focal y la endocitosis [89]. En las células de feocromocitoma de rata (células PC12), el grafeno y el rGO causaron efectos citotóxicos y lesiones mitocondriales, como la liberación de lactato deshidrogenasa (LDH), un aumento en la activación de la caspasa-3 y la generación de ROS [82, 116].
El grafeno puede aumentar la viabilidad celular [117] o causar la muerte celular [118] dependiendo de la línea celular, el tipo de material de grafeno y la dosis. Se observó citotoxicidad por GO en fibroblastos humanos y células epiteliales pulmonares a concentraciones superiores a 20 μg/ml después de 24 h, pero se encontró toxicidad mínima en células A549 a concentraciones superiores a 50 μg/ml [119]. Las respuestas biológicas inducidas por GO como ROS, malondialdehído (MDA) y LDH aumentaron, mientras que la superóxido dismutasa (SOD) disminuyó dependiendo de la dosis en las células HeLa [120]. Sin embargo, go-molecular beacon (GO-MB) mostró baja citotoxicidad incluso a 20 μg/mL en células HeLa [121]. GO disminuyó la viabilidad de las células A549, mientras que la misma concentración y tiempo de exposición aumentaron la viabilidad celular de las células de carcinoma colorrectal CaCo2 [122]. Otro estudio informó que GO mejoró dramáticamente la diferenciación de SH-SY5Y, acompañado de un aumento de la longitud de la neurita y la expresión del marcador neuronal MAP2 a bajas concentraciones, pero que GO suprimió la viabilidad de las células SH-SY5Y a dosis altas (≥80 mg / ml) [123]. Los recubrimientos funcionalizados en GO, como GO-PEG [124] y GO-quitosano [125], pueden atenuar profundamente la citotoxicidad de las partículas al inhibir las interacciones entre las células.
La toxicidad de los GFN in vitro se resume en la Tabla 2. Los datos sobre la citotoxicidad de los nanomateriales de grafeno son contrastantes, y las características variables influyen en los resultados. Los mecanismos y factores de influencia de la toxicidad deben dilucidarse en detalle.
Orígenes de la toxicidad de las GFN
Según se informa,
las características del grafeno, incluida su concentración, dimensión lateral, estructura superficial, grupos funcionales, pureza y proteína corona, influyen fuertemente en su toxicidad en los sistemas biológicos [2, 7, 104, 126–129].
Concentración
Numerosos resultados han demostrado que los materiales de grafeno
causan toxicidad dependiente de la dosis en animales y células, como lesión hepática y renal, formación de granuloma pulmonar, disminución de la viabilidad celular y apoptosis celular [130–134].
En estudios in vivo, GO no mostró toxicidad obvia en ratones expuestos a una dosis baja (0,1 mg) y una dosis media (0,25 mg), pero indujo toxicidad crónica a una dosis alta (0,4 mg). El alto contenido de GO se depositó principalmente en los pulmones, el hígado, el bazo y los riñones y fue difícil de limpiar por los riñones a través de una sola inyección en la vena de la cola [135].
Curiosamente, el aumento de la dosis resultó en una disminución dramática en la captación hepática, pero un aumento en la absorción pulmonar de s-GO por inyección intravenosa [31], porque la alta dosis de GO potencialmente superó la saturación de absorción o agotó la masa de opsoninas plasmáticas, lo que en consecuencia suprimió la absorción hepática.
Además, un estudio in vitro informó que las nanoláminas GO de 20 μg/mL no mostraron citotoxicidad en A549 dentro de las 2 h de la incubación, pero una concentración más alta (85 μg/mL) disminuyó la viabilidad celular al 50 % dentro de las 24 h [136, 137]. Lü et al. también demostraron que GO no tenía citotoxicidad obvia a bajas concentraciones durante 96 h en una línea celular de neuroblastoma humano SH-SY5Y, pero la viabilidad de las células disminuyó bruscamente al 20 % después del tratamiento con 100 mg / ml de GO durante 96 h de incubación [123]. Los resultados en células HeLa, células T3 NIH-3 y células de cáncer de mama (SKBR3, MCF7) tratadas con nanocintas de grafeno también mostraron una disminución de la dosis (10-400 mg / ml) y dependiente del tiempo (12-48 h) en la viabilidad celular [138]. El aumento de las concentraciones de GO entró en los lisosomas, las mitocondrias, el endoplasma y el núcleo celular [119]. Varios datos indicaron que rGO causó muerte celular mediada por apoptosis a una dosis más baja y un punto de tiempo temprano, pero que la necrosis fue prevalente con el aumento en el tiempo / dosis [110, 135].
Dimensión lateral
Las nanopartículas con tamaños <100 nm pueden ingresar a la célula, <40 nm pueden ingresar al núcleo y más pequeñas que <35 nm pueden cruzar la barrera hematoencefálica [85].
Un estudio mostró que GO (588, 556, 148 nm) no entró en las células A549 y no tuvo citotoxicidad obvia [112]. Cuando el diámetro del grafeno está entre 100 ~ 500 nm, el tamaño más pequeño puede causar la toxicidad más grave, y cuando el diámetro está por debajo de 40 nm, los tamaños más pequeños pueden ser los más seguros. Por ejemplo, rGO con un diámetro de 11 ± 4 nm podría entrar en el núcleo de las hMSC y causar aberraciones cromosómicas y fragmentación del ADN a concentraciones muy bajas de 0,1 y 1,0 mg/ml en 1 h. Sin embargo, las láminas de rGO con diámetros de 3,8 ± 0,4 nm no mostraron una genotoxicidad notable en las hMSC, incluso a una dosis alta de 100 mg / ml después de 24 h [118].
En un estudio in vivo, s-GO (100-500 nm) se acumuló preferentemente en el hígado, mientras que l-GO (1-5 μm) se localizó principalmente en los pulmones porque l-GO formó complejos de proteína GO más grandes que fueron filtrados por los vasos capilares pulmonares después de la inyección intravenosa [31]. Dados los tamaños laterales relativos (205,8 nm, 146,8 nm y 33,78 nm) de las tres nanoláminas de GO a la misma concentración, el GO más pequeño experimenta una absorción mucho mayor que el GO más grande en las células Hela [139]. La alta absorción de s-GO cambió en el microambiente de las células y, en consecuencia, indujo la mayor pérdida de viabilidad y el estrés oxidativo más grave entre tres tamaños de muestras de GO [119]. Como resultado, un estudio delineó que la glucemia M1 inducida por gosimétricamente la polarización M1 de los macrófagos y las respuestas proinflamatorias in vitro e in vivo. El GO más grande mostró una adsorción más fuerte en la membrana plasmática con menos fagocitosis, provocando interacciones robustas con TLR y activando las vías NF-κB, en comparación con las láminas de GO más pequeñas, que probablemente fueron absorbidas por las células [94]. Para descubrir aún más el mecanismo detallado que subyace a estos efectos, se necesitan más estudios para ilustrar el mecanismo vital del tamaño lateral de los materiales de grafeno.
Estructura de superficie
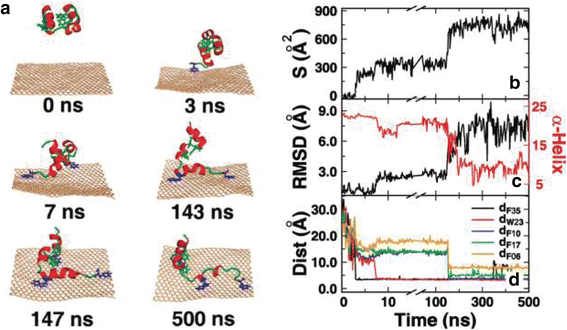
Los GNG poseen químicas superficiales muy variadas. Por ejemplo, la superficie prístina de grafeno es hidrofóbica, la superficie de GO es parcialmente hidrofóbica con grupos carboxilato [140–142], y rGO tiene hidrofilicidad intermedia [143]. Se observó que los GNG interrumpen la función y la estructura de las membranas celulares y las proteínas, probablemente por interacciones moleculares excepcionalmente fuertes con las células [2, 91]. Por ejemplo, rGO se unió a las membranas celulares, estimuló los receptores y activó las vías mitocondriales, induciendo la apoptosis [110, 111, 144]. La evidencia limitada mostró que el GO es más pequeño y menos tóxico que el rGO debido al alto contenido de oxígeno, los bordes más suaves y las propiedades hidrófilas de la especie anterior [104, 145, 146]. Debido a los diferentes estados de oxidación superficial de GO y rGO, GO que posee una hidrofilicidad distinta podría ser internalizado y absorbido fácilmente por las células HepG2. Por el contrario, rGO con hidrofobicidad evidente, podría ser adsorbido y agregado en superficies celulares sin (o con menor) absorción [110]. Debido a las fuertes interacciones de apilamiento π-π, el grafeno tiene una gran capacidad para romper muchos residuos de la proteína, particularmente los aromáticos, como el tocado villin (HP), F10, W23 y F35. Las estructuras secundarias y terciarias de la proteína se encuentran en gran parte en la superficie del grafeno, interrumpiendo la estructura y función de la proteína [41] (Fig. 2). Además, GO puede insertarse entre los pares de bases de ADN de doble cadena y perturbar el flujo de información genética a nivel molecular, lo que podría ser una de las principales causas del efecto mutagénico de GO [7, 112, 146, 147].
Una trayectoria representativa de HP35 adsorbiéndose sobre el grafeno. a) Instantáneas representativas en varios momentos. Las proteínas se muestran en dibujos animados con hélice roja y bucle verde, y el grafeno se muestra en trigo. Los residuos aromáticos que forman las interacciones de apilamiento π-π se muestran en azul, otros se muestran en verde. b) La superficie de contacto de HP35 con el grafeno. c) El RMSD de HP35 a partir de su estructura nativa y el número de residuos en la estructura de α hélice. Aquí, las estructuras secundarias están determinadas por el programa DSSP. d) La distancia entre el grafeno y los residuos aromáticos, incluidos F35, W23, F10, F17 y F06. Para mostrar el proceso de adsorbimiento más claro, el eje χ había sido truncado y reescalado. [41] Copyright (2011), con permiso de Journal of Physical of Chemistry
Carga
Varios estudios han destacado la importancia de la carga superficial de GO debido a su capacidad para afectar el mecanismo de internalización y absorción de las células [148-150]. La internalización de GO fue insignificante en no fagocitos, lo que probablemente se debió a la fuerte repulsión electrostática entre el GO cargado negativamente y la superficie celular [34]. Sin embargo, otros han sugerido que las nanopartículas cargadas negativamente pueden internalizarse en células no fagocíticas al unirse a los sitios catiónicos disponibles en la superficie celular y ser absorbidas por los receptores carroñeros [110, 146, 150]. Según los informes, las partículas de GO/GS causan cambios morfológicos y lisis significativa, lo que lleva a una alta hemólisis en los glóbulos rojos (glóbulos rojos). La interrupción de la membrana de los glóbulos rojos probablemente se atribuye a las fuertes interacciones electrostáticas entre los grupos de oxígeno cargados negativamente en la superficie GO / GS y los lípidos fosfatidilcolina cargados positivamente en la membrana externa de los glóbulos rojos [106].
Funcionalización
Los estudios confirmaron que la funcionalización con PEG [52], grupos de poli-L-lisina (PLL) PEGilada [151], poli(ε-caprolactona) [152], alcohol polivinílico [3], plurónico [153], amina [98], carboxilo y dextrano [79] disminuye en gran medida la toxicidad y mejora la biocompatibilidad del grafeno. Los resultados in vivo revelaron que solo surgió una inflamación crónica leve después de la inyección subcutánea de hidrogel GO-Pluronic y no se probó toxicidad notable a corto plazo después de la inyección intravenosa de GO-DEX [79, 154]. PEGylated GS no indujo toxicidad apreciable en ratones expuestos a 20 mg / kg durante 3 meses, según lo evaluado por la bioquímica sanguínea y los exámenes histológicos, y mostró una retención relativamente baja en el RES [52, 155]. El recubrimiento de GO con quitosano casi eliminó la actividad hemolítica en la sangre [39]. Además, el recubrimiento PEG alivió eficazmente las lesiones tisulares agudas inducidas por GO; disminución de la agregación y retención de GO en el hígado, los pulmones y el bazo; y promovió la eliminación de GO [81], GO-DEX [79] y óxido de grafeno fluorado (FGO) [156].
In vitro, varios ensayos de función celular mostraron evidencia clara de que la funcionalización superficial del grafeno prístino o GO fue crítica para reducir los fuertes efectos de toxicidad [91]. PEG-GO, PEI-GO y LA-PEG-GO dañaron las células de fibroblastos pulmonares humanos menos que GO [148]. PEG-GO no mostró citotoxicidad hacia varios cultivos celulares, como las células de glioblastoma (U87MG), las células de cáncer de mama (MCF-7), las células de carcinoma de ovario humano (OVCAR-3), las células de cáncer de colon (HCT-116) y las células linfoblastoides (RAJI), en concentraciones de hasta 100 μg / ml [119, 157, 158]. Los GQD-PEG exhibieron una toxicidad muy baja o nula contra las células de cáncer de pulmón y cuello uterino, incluso a concentraciones muy altas (200 μg / ml) [159]. Sin embargo, como material no biodegradable con gran potencial para la internalización celular, se necesita más investigación para evaluar los posibles efectos adversos a largo plazo del grafeno funcionalizado.
Agregaciones y sedimentación
Según se informa, los nanomateriales tienen una propensión a formar agregados en lugar de unidades individuales, particularmente en condiciones fisiológicas. Las superficies GS permitieron que se unieran menos glóbulos rojos en comparación con GO, y GS tuvo la menor actividad hemolítica para la formación de agregaciones más acuosas. En contraste, la rápida sedimentación y la formación de agregados de GS inhibieron en gran medida la disponibilidad de nutrientes de las células de fibroblastos de la piel humana que se cultivaron en el fondo de los pozos [106]. Por lo tanto, las agregaciones y sedimentación de partículas de grafeno ejercen efectos variables en diferentes células.
Impurezas
La pureza de los nanomateriales es una consideración importante porque los metales residuales y contaminantes pueden ser responsables de la toxicidad observada, en lugar del nanomaterial en sí, lo que ha dado lugar a datos contradictorios sobre la citotoxicidad de las GFN [35, 160]. El GO preparado tradicionalmente a menudo contiene altos niveles de Mn2+ y Fe2+, que son altamente mutagénicos para las células. La liberación inespecífica de estos iones de GO preparados tradicionalmente podría conducir a niveles inusualmente altos de citotoxicidad y fracturación de ADN [39]. En particular, Peng et al. [161] produjeron GO de alta pureza que contenía solo 0,025 ppm Mn2+ y 0,13 ppm de Fe2+, y Hanene et al. [162] inventaron un nuevo método para preparar láminas GO de una sola capa de alta pureza con buena dispersibilidad acuosa y estabilidad coloidal. El GO producido por estos nuevos métodos no indujo respuestas citotóxicas significativas (a dosis de exposición de hasta 100 μg/ml) in vitro, y no se observó una respuesta inflamatoria obvia ni formación de granuloma (dosis de exposición de hasta 50 μg/animal) in vivo. Por lo tanto, la pureza de las GFN merece atención y es un paso vital hacia la determinación de las GFN involucradas en las bioaplicaciones.
Efecto corona de las proteínas
Debido a la alta carga superficial libre,
los nanomateriales pueden formar fácilmente «coronas» con proteínas en sistemas biológicos [163, 164].
Se sugiere que la proteína corona afecta la circulación, distribución, eliminación y toxicidad de las nanopartículas. Varios artículos informaron que
GO forma coronas de proteína GO con proteínas plasmáticas adsorbidas en suero
y estas coronas de proteína GO juegan un papel importante en la decisión del destino del comportamiento biocinético de GO in vivo. Tales coronas de proteína GO pueden regular la adhesión de GO a las células endoteliales e inmunes a través de interacciones específicas e inespecíficas [165].
Básicamente,
la inmunoglobulina G y las proteínas del complemento en la proteína corona ayudan a reorganizar las nanopartículas en las células inmunes, haciendo que las partículas sean engullidas por el RES, y el GO recubierto de IgG fue absorbido por interacciones específicas o inespecíficas con los receptores de la membrana celular [31, 165].
Sin embargo, otro estudio encontró que GO no podía adherirse a las células epiteliales de la mucosa directamente en el tracto intestinal después de que los ratones filiales bebieran una solución acuosa de GO porque las proteínas abundantes en la leche se habían adsorbido en la superficie del GO y, por lo tanto, inhibían su interacción directa con las células epiteliales de la mucosa [53].
La proteína corona mitigó la citotoxicidad de GO al limitar su interacción física con la membrana celular y reducir el daño morfológico celular en las células HeLa, THP-1 y A549 [166–168]. El efecto citotóxico se redujo en gran medida cuando GO se recubrió previamente con FBS y se incubó con células; se observó una supervivencia de casi ∼ 90 % con GO recubierto de FBS de 100 μg/ml y una supervivencia del 100 % con GO recubierto de FBS de 20 μg/mL. Se observaron tendencias similares para el GO cubierto por BSA [166, 169]. Consistentemente, el suero adicional podría neutralizar la toxicidad de GO prístino en J774. Células A1 a una dosis de 4 μg/ml, que conducen a una disminución del número de células del 52,5 % en comparación con las células no tratadas [89].
Después de revisar muchos estudios,
se puede concluir que la toxicidad del grafeno está influenciada por múltiples factores.
Esos factores se combinaron para cambiar en gran medida la toxicidad de los GNG en muchos casos.
Los estudios científicos a menudo necesitan la identificación clara de causa y efecto, que debe mantener solo un factor diferente a la vez, para que se pueda determinar el efecto de ese factor único.
Pero en algunos artículos,
se estudiaron varios factores que influyen en la toxicidad de las GFN al mismo tiempo, lo que condujo a resultados confusos.
Posibles mecanismos de toxicidad de las GFN
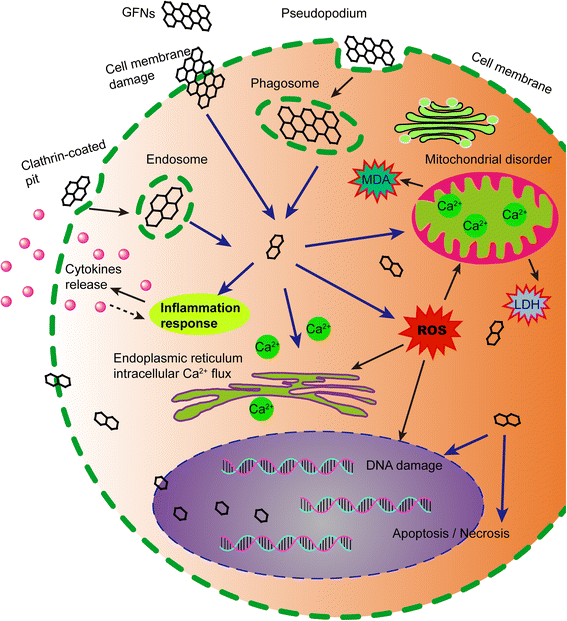
Aunque algunas propiedades fisicoquímicas y la toxicidad de las GFN han sido bien estudiadas por muchos estudiosos, los mecanismos exactos que subyacen a la toxicidad de las GFN siguen siendo oscuros. En la Fig. 3 se ilustra un esquema de los principales mecanismos de citotoxicidad de las GFN.
El diagrama esquemático mostró los posibles mecanismos de citotoxicidad de las GFN. Los GNF entran en las células a través de diferentes formas, que inducen en la generación de ROS, el aumento de LDH y MDA, y Ca2+ Lanzamiento. Posteriormente, los GNF causan tipos de lesiones celulares, por ejemplo, daño a la membrana celular, inflamación, daño al ADN, trastornos mitocondriales, apoptosis o necrosis.
Destrucción física
El grafeno es un nanomaterial único en comparación con otras nanopartículas esféricas o unidimensionales debido a su estructura bidimensional con carbonos sp2. La interacción física de las nanopartículas de grafeno con las membranas celulares es una de las principales causas de citotoxicidad del grafeno [7, 170, 171]. El grafeno tiene una alta capacidad para unirse con las estructuras α-helicoidales de los péptidos debido a su curvatura superficial favorable [172]. A una concentración superior a 75 μg / ml, el grafeno prístino se adhirió en gran medida a las superficies de las células RAW 264.7 y resultó en un estiramiento anormal de la membrana celular [104]. Las fuertes interacciones hidrofóbicas de los GNF con la membrana celular conducen a la extensión morfológica de la F-actina filopodial y la disfunción citoesquelética. Además, los bordes afilados del GNS pueden actuar como «cuchillas», insertando y cortando a través de las membranas celulares bacterianas [173]. Además, GO también dañó la membrana externa de la bacteria E. coli directamente, lo que resultó en la liberación de componentes intracelulares [173]. Sin embargo, las imágenes TEM revelaron que el recubrimiento previo de GO con FBS eliminó la destrucción de las membranas celulares [166].
Producción de ROS que conduce al estrés oxidativo
El estrés oxidativo surge cuando el aumento de los niveles de ROS abruma la actividad de las enzimas antioxidantes, incluidas la catalasa, la SOD o la glutatión peroxidasa (GSH-PX) [174].
Las ROS actúan como segundos mensajeros en muchas cascadas de señalización intracelular y
conducen a daños macromoleculares celulares, como la descomposición de los lípidos de la membrana, la fragmentación del ADN, la desnaturalización de proteínas y la disfunción mitocondrial, que influyen en gran medida en el metabolismo celular y la señalización [175-177].
Las interacciones de GO con las células pueden conducir a la generación excesiva de ROS, que es el primer paso en los mecanismos de carcinogénesis, envejecimiento y mutagénesis [83, 122].
El estrés oxidativo tuvo un papel significativo en la lesión pulmonar aguda inducida por GO [30], y las respuestas inflamatorias causadas por el estrés oxidativo a menudo surgieron al exponerse a las GFN [133, 177, 178].
La actividad de SOD y GSH-PX disminuyó después de exponerse a GO de una manera dependiente del tiempo y la dosis [82, 106, 119].
Del mismo modo,
el estrés oxidativo fue la causa clave de la apoptosis y el daño al ADN después de que las células HLF fueron expuestas a GO [148].
Tanto la proteína quinasa activada por mitógenos (MAPK) (JNK, ERK y p38) como las vías de señalización relacionadas con TGF-beta fueron desencadenadas por la generación de ROS en células prístinas tratadas con grafeno, acompañadas por la activación de Bim y Bax, que son dos miembros pro-apoptóticos de la familia de proteínas Bcl-2. Como resultado, se activó la caspasa-3 y sus proteínas efectoras aguas abajo, como PARP, y se inició la apoptosis [83, 179].
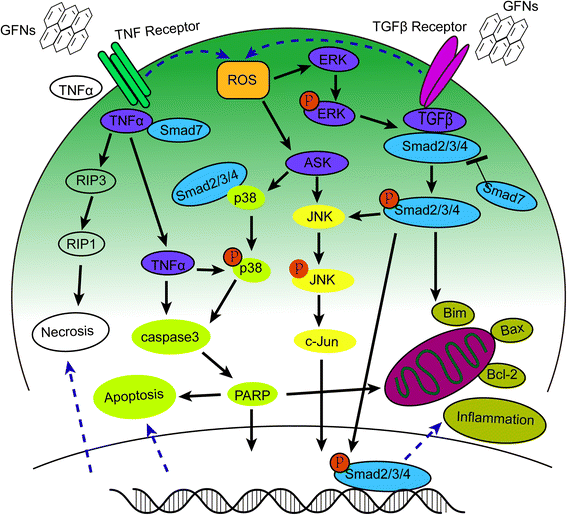
La información detallada sobre las vías de señalización relacionadas con MAPK-, TGF-β- y TNF-α, que inducen inflamación, apoptosis y necrosis, se resumen en la Fig. 4.
Diagrama esquemático de MAPKs, TGF-beta y TNF-α vías dependientes involucradas en la toxicidad de GFNs. ROS fueron los principales factores que activaron las vías de señalización MAPKs y TGF-beta para conducir a la activación de Bim y Bax, desencadenando la cascada de caspasas y la vía JNK. La activación de la caspasa 3 y RIP1 dio lugar a apoptosis y necrosis finalmente
Daño mitocondrial
Las mitocondrias son centros de producción de energía involucrados en varias vías de señalización en las células y también son un punto clave de la regulación apoptótica [83]. Después de la exposición a GO y carboxilo grafeno (GXYG), la membrana mitocondrial se despolarizó y la cantidad de mitocondrias disminuyó en las células HepG2 [180]. La exposición a las GFN resultó en un aumento significativo del consumo de oxígeno mitocondrial acoplado y desacoplado, la disipación del potencial de la membrana mitocondrial y el eventual desencadenamiento de la apoptosis mediante la activación de la vía mitocondrial [181]. Por ejemplo, GO aumentó la actividad de los complejos de transporte de electrones mitocondriales I / III y el suministro de electrones al sitio I / II de la cadena de transporte de electrones, acelerando la generación de ROS durante la respiración mitocondrial en células MHS [99]. La formación de •OH mediada por GO y el citocromo-c/H2O2.
El sistema de transferencia de electrones podría mejorar el estrés oxidativo y térmico para deteriorar el sistema de respiración mitocondrial y, finalmente, resultar en una toxicidad dramática [151].
Además, las fracciones de oxígeno en el GO podrían aceptar electrones de proteínas redox celulares, apoyando el ciclo redox del citocromo C y las proteínas de transporte de electrones, y los citocromos MtrA, MtrB y MtrC / OmcA podrían estar involucrados en la transferencia de electrones a GO [182].
Por lo tanto,
a excepción del daño de la membrana plasmática y la inducción del estrés oxidativo, los GNG pueden causar apoptosis y/o necrosis celular al influir directamente en la actividad mitocondrial celular [183, 184].
Daño en el ADN
Debido a su pequeño tamaño, alta superficie y carga superficial,
el GO puede poseer propiedades genotóxicas significativas y causar daños graves en el ADN, por ejemplo, fragmentación cromosómica, roturas de hebras de ADN, mutaciones puntuales y aductos y alteraciones oxidativas del ADN [87, 122, 185, 186].
Se observó mutagénesis en ratones después de la inyección intravenosa de GO a una dosis de 20 mg/kg en comparación con la ciclofosfamida (50 mg/kg), un mutágeno clásico [112].
Incluso si GO no puede entrar en el núcleo de una célula,
aún puede interactuar con el ADN durante la mitosis cuando la membrana nuclear se rompe, lo que aumenta la oportunidad de aberraciones del ADN [87, 147, 187, 188].
La interacción de apilamiento π entre los anillos de carbono de grafeno y los pares de bases de ADN hidrófobo puede hacer que un segmento de ADN se «ponga de pie» o «se coloque sobre» la superficie del grafeno con su eje helicoidal perpendicular o paralelo, respectivamente. Las fuerzas intermoleculares deforman severamente los pares de bases finales del ADN, lo que potencialmente aumenta la genotoxicidad [189]. GO también puede inducir fragmentación cromosómica, aductos de ADN y mutaciones puntuales al promover el estrés oxidativo o desencadenar la inflamación a través de la activación de vías de señalización intracelular como MAPK, TGF-β y NF-κB [110, 112, 146]. El grafeno y rGO también pueden elevar la expresión de p53, Rad51 y MOGG1-1, que reflejan el daño cromosómico, y disminuir la expresión de CDK2 y CDK4 al detener la transición del ciclo celular de la fase G1 a la S en varias líneas celulares [112].
El daño en el ADN no solo puede iniciar el desarrollo del cáncer, sino que también puede amenazar la salud de la próxima generación si surge el potencial mutagénico del GO en las células reproductivas, lo que afecta la fertilidad y la salud de la descendencia [112, 190].
Respuesta inflamatoria
Las GFN pueden causar una respuesta inflamatoria significativa que incluye infiltración de células inflamatorias, edema pulmonar y formación de granuloma a dosis altas a través de instilación intratraqueal o administración intravenosa [30, 49].
Las plaquetas son los componentes importantes en la formación de coágulos para atacar patógenos y partículas durante la respuesta inflamatoria, y el GO podría activar directamente la formación de trombos ricos en plaquetas para ocluir los vasos pulmonares después de la inyección intravenosa [98, 191].
Una fuerte respuesta inflamatoria fue inducida por inyección subcutánea con GO durante 21 días, junto con la secreción de citoquinas clave, incluyendo IL-6, IL-12, TNF-α, MCP-1 e IFN-g [34, 192].
Las GFN pueden desencadenar una respuesta inflamatoria y una lesión tisular al liberar citoquinas y quimiocinas que conducen al reclutamiento de monocitos circulantes y estimulan la secreción de citoquinas y quimiocinas Th1 / Th2 [124, 193].
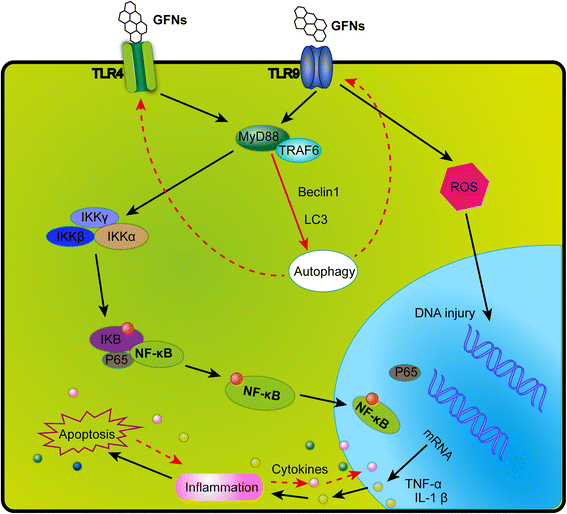
Además, el grafeno prístino [193] y el rGO [110] evocan una respuesta inflamatoria al unirse a receptores tipo toll (TLR) y activar la vía de señalización NF-κB en las células. La cascada de señalización NF-κB es desencadenada por TLR y citoquinas proinflamatorias como IL-1 y TNF-α. Tras la activación, NF-κB se desplaza del citoplasma al núcleo, facilitando la unión de la degradación de IκB y actuando como un factor de transcripción para sintetizar numerosas citoquinas proinflamatorias [194]. En la Fig. 5 se muestra un esquema de la vía de señalización de TLR4 y TLR9 activada por GFNs.
Un diagrama esquemático que aclara la vía de señalización de TLR4 y TLR9 responsables de la citotoxicidad inducida por GFN. Los GNF pueden ser reconocidos por TLRs, activando así IKK e IκB por un mecanismo dependiente de MyD88, lo que resulta en la liberación de subunidades NF-κB e inicia la translocación en el núcleo. Así, los factores proinflamatorios fueron transcritos y secretados fuera del núcleo, modulando las respuestas inmunes iniciando la autofagia programada, la apoptosis y la necrosis.
Apoptosis
La apoptosis se define como la autodestrucción de una célula regulada por genes a través de programas complicados [83, 195].
GO y rGO causaron apoptosis e inflamación en los pulmones de los ratones después de la inhalación [99], y los GFN también tuvieron efectos proapoptóticos en las células [111, 113, 124, 196].
Además, el grafeno y el GO dañaron físicamente las membranas celulares [166], aumentaron la permeabilización de la membrana mitocondrial externa y cambiaron el potencial de la membrana mitocondrial; el aumento de ROS desencadenó las vías de señalización MAPK y TGF-β y activó la caspasa-3 a través de cascadas apoptóticas dependientes de mitocondrias, lo que provocó la ejecución de apoptosis [83, 99].
Del mismo modo, rGO causó apoptosis a una dosis baja y un punto de tiempo temprano, desencadenado por el receptor de muerte y la vía mitocondrial canónica [110].
Otro estudio mostró tres vías diferentes de apoptosis por GFN: GO condujo a la apoptosis dependiente de ROS a través de la interacción directa con los receptores de proteínas y la posterior activación de la vía del linfoma de células B-2 (Bcl-2); GO-COOH transmitió una señal de apoptosis pasiva al ADN nuclear uniéndose a los receptores de proteínas y activando una vía independiente de ROS; Sin embargo, GO-PEI dañó severamente las membranas de los linfocitos T para desencadenar la apoptosis [105, 197].
Autofagia
La autofagia es el proceso de autodegradación de los componentes celulares y recientemente reconocido como muerte celular no apoptótica [198-200]. La activación de la autofagia requiere la formación de autofagosomas que contienen Beclin 1, múltiples proteínas relacionadas con la autofagia (ATG), cadena ligera 3 (LC3) de proteínas asociadas a microtúbulos y p62 [201].
La acumulación de autofagosomas se asocia con la exposición a varias nanopartículas [202-205], y la autofagia puede eliminar organismos extracelulares y destruir los organismos en el citosol [206]. Se demostró que GO y GQD inducen la acumulación de autofagosomas y la conversión de LC3-I a LC3-II; inhibir la degradación de la proteína p62 del sustrato autofágico [207, 208]. Además, GO puede desencadenar simultáneamente respuestas TLR4 y TLR9 en macrófagos [34, 192] y células de cáncer de colon CT26 [206]. La vía de la autofagia está vinculada a la fagocitosis por señalización TLR en macrófagos [206, 209].
Necrosis
La necrosis es una forma alternativa de muerte celular inducida por respuestas inflamatorias o lesiones celulares.
La exposición de las células al grafeno prístino causa apoptosis y necrosis a dosis altas (50 mg /ml) [83].
Según se informa, la fuga de LDH y la apertura del poro de transición de permeabilidad mitocondrial, inducida por un nivel elevado de Ca citoplasmático2+, conducen a apoptosis/necrosis [210]. Se reveló que el tratamiento con GO induce necrosis macrofágica mediante la activación de la señalización TLR4 y, posteriormente, desencadena parcialmente la producción autocrina de TNF-α [93].
GO combinado con CDDP (GO/CDDP) desencadenó necrosis al disminuir RIP1 y aumentar las proteínas RIP3, acompañadas de la liberación del grupo B1 de alta movilidad (HMGB1) en el citosol desde el núcleo y fuera de las células CT26 [205, 211, 212].
Cambios epigenéticos
La epigenética involucra la metilación del ADN, la impronta genómica, los efectos maternos, el silenciamiento de genes y la edición de ARN [213–215].
La metilación del ADN, que es una de las modificaciones epigenéticas mejor estudiadas, incluye fosforilación, ubiquitinación y ATP-ribosilación y puede conducir a la remodelación de la cromatina [197, 216, 217].
Un artículo reciente informó que la exposición a SL-GO / FL-GO resultó en hipermetilación global del ADN a través de la regulación ascendente de los genes DNMT3B y MBD1. El tratamiento con PNB causó hipometilación al disminuir la expresión de los genes DNMT3B y MBD1 [216]. GO podría activar la vía de regulación miRNA-360 para suprimir la cascada de señalización de daño al ADN-apoptosis al afectar el componente de CEP-1 [218].
Tomados en conjunto,
estos datos sugieren que los GFN podrían causar cambios sutiles en la programación de la expresión génica al modular los cambios epigenéticos.
Sin embargo, los estudios de los cambios epigenéticos inducidos por GFN son pocos, y el mecanismo epigenético causado por la exposición a GFN no se entiende completamente.
Para concluir, muchos estudios han discutido mecanismos representativos de toxicidad de GFN que involucran cuatro vías de señalización: TLR, TGF-β, TNF-α y MAPK.
Estas cuatro vías de señalización son correlativas y moduladoras cruzadas, lo que hace que
la respuesta inflamatoria, la autofagia, la apoptosis y otros mecanismos sean independientes y, sin embargo, estén conectados entre sí.
Además,
el estrés oxidativo parece desempeñar el papel más importante en la activación de estas vías de señalización.
Se ha reportado que existen intersecciones de apoptosis, autofagia y necrosis en los estudios de toxicidad de otros nanomateriales, inhiben o promueven mutuamente en algunas condiciones. Sin embargo, las vías de señalización de la toxicidad de las GFN investigadas en los documentos hasta la fecha son solo una pequeña parte de una red intrincada, y la red de vías de señalización debe explorarse en detalle en el futuro.
Brechas de datos y estudios futuros
Actualmente, la literatura es insuficiente para establecer conclusiones sobre los peligros potenciales de las GFN. Dos opiniones opuestas han comenzado a surgir: algunos investigadores sugirieron que los materiales de grafeno son biocompatibles en una serie de estudios centrados en aplicaciones biomédicas [119, 154, 162, 219], y otros estudios informaron respuestas biológicas adversas y citotoxicidad [32, 118, 135, 138, 192 ]. Estos resultados inconsistentes podrían haber sido causados por varios factores, incluidos los diferentes grupos de investigación, varios modelos celulares o animales y diversas caracterizaciones fisicoquímicas de las GFN. Cuando se exploran las GFN para aplicaciones in vivo en el cuerpo humano o algunas otras aplicaciones biomédicas, se debe considerar la biocompatibilidad, y se necesitan estudios más detallados y precisos de la toxicidad de las GFN.
En primer lugar, la caracterización fisicoquímica detallada es imperativa en todos los estudios futuros de toxicidad por GFN. En los experimentos, las descripciones de características de los GNF deben incluir su tamaño, morfología, área de superficie, carga, modificaciones de superficie, pureza y aglomeración [88, 141, 148, 162]. Debido a que estos factores fisicoquímicos influyen en gran medida en la toxicidad y biocompatibilidad de los GNG, se deben considerar los diseños experimentales de un solo factor y la exclusión de otros factores interferentes. También se deben proporcionar detalles del proceso de fabricación porque los desechos oxidativos formados podrían alterar en gran medida la estructura superficial del grafeno y el GO durante la funcionalización [151]. Es importante destacar que se debe establecer un método único y universal en la tecnología de grafeno, que permita una mejor comparación de los datos de diferentes estudios o diferentes laboratorios.
En segundo lugar, diferentes criterios observacionales, parámetros y selección de métodos experimentales podrían inducir grandes variaciones entre laboratorios [220, 221]. Por ejemplo, el ensayo MTT siempre no predice con precisión la toxicidad del grafeno porque la reducción espontánea da como resultado una señal de falso positivo. Por lo tanto, se deben utilizar evaluaciones alternativas apropiadas, como el reactivo de sal de tetrazolio soluble en agua (WST-8), el ensayo ROS y la prueba de exclusión de azul de tripano [106, 222]. Además, el ensayo del cometa a menudo muestra niveles más altos de daño en el ADN que el ensayo de micronúcleos porque el primero mide la lesión reparable y el segundo mide el daño genético que queda después de la división celular [159, 223]. Por lo tanto, se requiere precaución al elegir el ensayo más apropiado para evaluar la toxicidad de los materiales de grafeno para evitar resultados falsos positivos.
En tercer lugar, la selección de líneas celulares es de vital importancia porque las líneas celulares de cáncer tienden a ser sensibles o resistentes dependiendo de sus antecedentes genéticos. Las mismas nanopartículas de grafeno pueden causar diferentes reacciones dependiendo de sus diversos orígenes celulares. Se deben utilizar líneas celulares adecuadas con buena estabilidad para evitar resultados falsos positivos o negativos. Las células primarias derivadas de humanos o animales pueden simular mejor las condiciones de salud de los humanos. Se ha utilizado una gran cantidad de células primarias para probar la toxicidad de otros nanomateriales [224-228], pero el cultivo de células primarias es extremadamente raro en los experimentos con GNF hasta la fecha [210, 229]. Se deben realizar varios experimentos celulares combinados con células primarias para evaluar exhaustivamente las propiedades fisicoquímicas y la toxicidad de los GNF.
En cuarto lugar, la vía de administración de los GFN juega un papel muy importante en los estudios de toxicidad, y los diferentes métodos de administración darán lugar a diferentes reacciones toxicológicas [32, 53]. Por lo tanto, la ruta y el período de exposición deben elegirse cuidadosamente de acuerdo con el objetivo del estudio.
La administración nasal de fármacos se utiliza a menudo para estudiar la neurotoxicidad de los nanomateriales [230, 231], pero este método de administración rara vez se ha aplicado en las pruebas de toxicidad de GFN.
Los estudios toxicológicos de GFN en el sistema nervioso son raros, y el mecanismo no está claro y debe estudiarse más a fondo en el futuro. Estudios toxicocinéticos recientes que involucran la absorción, distribución, metabolismo, acumulación y excreción de GFN a través de diferentes vías de exposición han arrojado algunos resultados, pero están lejos de ser suficientes para aclarar los complejos mecanismos internos. Por ejemplo, se necesitan más estudios para comprender los mecanismos moleculares específicos de las GFN que pasan a través de las barreras fisiológicas y la cantidad de acumulación o el período de excreción de las GFN en los tejidos. Además, dado el aumento de la exposición de los seres humanos a las GFN, la evaluación de la toxicidad sistémica en el cuerpo humano es indispensable en estudios futuros.
Quinto, otro tema importante que requiere atención es el destino a largo plazo de los GFN después de ingresar al cuerpo o ser absorbidos por las células.
Los estudios más recientes han consistido en evaluaciones de toxicidad a corto plazo [89, 232], y el daño tóxico a largo plazo no ha recibido mucha atención desde la aplicación generalizada de GFN en 2008.
Además, una superficie de grafeno funcionalizada puede mejorar su biocompatibilidad, pero se debe considerar la estabilidad a largo plazo de los recubrimientos superficiales [233]. Si los recubrimientos superficiales eventualmente se descomponen, su toxicidad puede ser significativamente diferente de los resultados de exposición a corto plazo. Se necesitan estudios extendidos para determinar si los tiempos de tratamiento más largos influyen en el potencial nanotóxico de las GNG.
En sexto lugar, es necesario descubrir y dilucidar vías de señalización más específicas en el mecanismo de toxicidad de las GFN. Actualmente, varios mecanismos de toxicidad típicos de las GFN han sido ilustrados y ampliamente aceptados, como el estrés oxidativo, la apoptosis y la autofagia. Sin embargo, estos mecanismos solo se han descrito en términos generales, y las vías de señalización específicas dentro de estos mecanismos deben investigarse en detalle. Las vías de señalización implicadas en la toxicidad de otros nanomateriales también pueden ser relevantes para el estudio de las GFN. Por lo tanto, se deben detectar más vías de señalización en futuras investigaciones. Por ejemplo, la nanoepigenética se ha considerado en numerosos estudios de nanomateriales, lo que también es útil para evaluar la toxicidad limitada y los efectos secundarios de los GNF. Estudios recientes han demostrado que los GFN podrían causar cambios epigenéticos y genómicos que podrían estimular la toxicidad física y la carcinogenicidad [234]. Los GNG tienen áreas de superficie altas, superficies continuas lisas y biopersistencia, similares a las propiedades de los implantes de estado sólido tumorigénicos.
Se desconoce si las GFN tienen el potencial de inducir sarcomas de cuerpos extraños, por lo que se deben realizar estudios definitivos de las potencialidades tumorales o los riesgos del grafeno lo antes posible.
Conclusiones
En los últimos años, las GFN se han utilizado ampliamente en una amplia gama de campos tecnológicos y biomédicos.
Actualmente,
la mayoría de los experimentos se han centrado en la toxicidad de los GFN en los pulmones y los hígados.
Por lo tanto,
los estudios de lesión cerebral o neurotoxicidad merecen más atención en el futuro.
Muchos experimentos han demostrado que los GFN tienen efectos secundarios tóxicos en muchas aplicaciones biológicas, pero se necesita urgentemente un estudio en profundidad de los mecanismos de toxicidad.
Además,
los resultados contrastantes con respecto a la toxicidad de los GNG deben abordarse mediante métodos experimentales efectivos y estudios sistemáticos.
Esta revisión proporciona una visión general de la toxicidad de las GFN al resumir la toxicocinética, los mecanismos de toxicidad y los factores influyentes, y tuvo como objetivo proporcionar información para facilitar la investigación exhaustiva sobre la hemocompatibilidad in vitro e in vivo de las GFN en el futuro.
Esta revisión ayudará a abordar las preocupaciones de seguridad antes de las aplicaciones clínicas y terapéuticas de las GFN, lo que será importante para un mayor desarrollo de las GFN en aplicaciones biológicas.
FUENTEY REFERENCIAS: BMC Part of Springer Nature. PUBLICADO: 31 de octubre de 2016. GD, 1 de octubre de 2022.